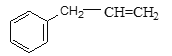题目内容
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
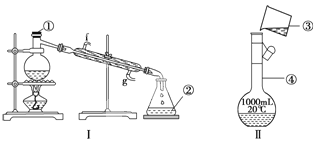
(1)写出下列仪器的名称:①__________,②__________,
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有______________,将仪器补充完整后进行的实验操作的名称为____________;
(3)用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
①应称取Na2CO3·10H2O晶体的质量:__________。
②所用仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还需要__________(填仪器名称)。
③根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
A.Na2CO3·10H2O晶体失去了部分结晶水 |
B.用“左码右物”的称量方法称量晶体(使用游码) |
C.称量碳酸钠晶体时所用砝码生锈 |
D.容量瓶未经干燥使用 |
其中引起所配溶液浓度偏高的有___________(填字母)
④装置Ⅱ是某同学转移溶液的示意图,图中的错误是__________________
【答案】蒸馏烧瓶 锥形瓶 温度计 蒸馏 28.6 g 500 mL容量瓶、胶头滴管 AC 未用玻璃棒引流,未采用500 mL容量瓶
【解析】
(1)根据装置中仪器的构造可知,①为蒸馏烧瓶,②为锥形瓶;
(2)利用蒸馏法分离四氯化碳和酒精的混合物,需要测蒸气的温度,所以还缺少的仪器是温度计;
(3)①用Na2CO3·10H2O晶体配制0.2 mol·L-1的Na2CO3溶液480 mL,需要500mL的容量瓶,Na2CO3·10H2O晶体的质量为m=cVM=0.2mol/L×0.5L×286g/mol=28.6g;
② 根据配制一定物质的量浓度溶液的操作过程可知,该实验还缺少的实验仪器为500 mL容量瓶及胶头滴管;
③A、Na2CO3·10H2O晶体失去了部分结晶水,碳酸钠质量增大,所得溶液浓度增大;
B、用“左码右物”的称量方法称量晶体(使用游码),碳酸钠质量偏小,所得溶液浓度偏小;
C、称量碳酸钠晶体时所用砝码生锈,碳酸钠质量增大,所得溶液浓度增大;
D、容量瓶未经干燥使用,对配制的溶液无影响;答案为AC;
④本实验需要用500mL的容量瓶;移液要用玻璃棒引流。

 阅读快车系列答案
阅读快车系列答案【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
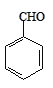 +Br2
+Br2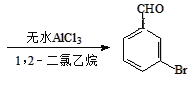 +HBr
+HBr
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
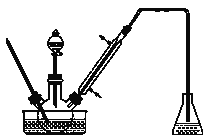
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_______,锥形瓶中应为_______(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_________。
A >229℃ B 58.8℃~179℃ C <58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的________(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_______。
(5)步骤4中采用减压蒸馏,是为了防止_______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为___。
(7) ![]() 是一种重要的医药中间体。请设计合理方案用
是一种重要的医药中间体。请设计合理方案用![]() 合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
例如:![]()
![]()
![]()
![]()
![]()