题目内容
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。 以下是氯元素形成物质的二维图的部分信息。
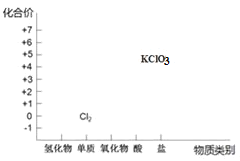
(1)根据图中信息,写出任意两种氯的含氧酸的化学式_____、_____。
(2)写出 NaOH 溶液吸收 Cl2 的离子方程式_____。
(3)实验室常用高锰酸钾固体与浓盐酸在常温下反应来快速制备少量氯气。反应方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①浓盐酸在上述反应中显示_____(填写序号)。
A 只有还原性 B 只有氧化性
C 既有氧化性又有酸性 D 既有还原性又有酸性
②当反应过程中有 6.02×1022 个电子发生转移时,生成 Cl2 的体积为_____(在标 准状况下),被氧化的 HCl 的物质的量为_____。
(4)潮湿的 Cl2 与 Na2CO3 混合制取少量 Cl2O 的反应中,Cl2既体现了氧化性,也体现了还原性,且生成2种盐。写出反应的化学方程式,并用双线桥标出电子转移的方向和数目_____。
【答案】HClO HClO2、HClO3、HClO4等中任意两种 2OH﹣+Cl2=ClO﹣+Cl﹣+H2O D 1.12L 0.1mol 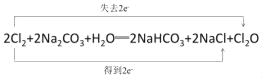
【解析】
分析氯元素形成物质的二维图,图中横坐标为氯元素形成物质的类别,纵坐标为氯元素的化合价,氯元素正化合价有+1、+3、+5、+7价等,这些正化合价都有对应的含氧酸。
(1)氯元素正化合价有+1、+3、+5、+7价等,所以含有氯元素的含氧酸有HClO、HClO2、HClO3、HClO4等;
(2)NaOH溶液吸收Cl2生成NaClO和NaCl,发生反应的离子方程式为2OH﹣+Cl2=ClO﹣+Cl﹣+H2O;
(3)①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中部分Cl元素的化合价从﹣1升高为0价,发生氧化反应,作还原剂,具有还原性,部分Cl元素化合价仍为﹣1价,未发生变化,起酸性作用,即反应中HCl既有还原性又有酸性,选项D符合题意;
②每生成1molCl2转移2mol电子,有2molHCl被氧化,当反应过程中有 6.02×1022 个电子发生转移时,电子的物质的量为0.1mol,则生成 Cl2 的物质的量为0.05mol,在标准状况下的体积为1.12L,被氧化的HCl为0.1mol;
(4)潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性,也体现了还原性,则该反应中生成氯化钠、Cl2O和碳酸氢钠,反应方程式为2Cl2+2Na2CO3+H2O═2NaHCO3+2NaCl+Cl2O,用双线桥分析电子转移数目和方向为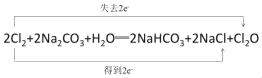 。
。

【题目】(1)工业制硝酸的主要反应为4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH;在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) ΔH;在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | c(NH3) (mol/L) | c(O2) (mol/L) | c(NO) (mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2 min | 0.6 | a | 0.2 |
第4 min | 0.3 | 0.975 | 0.5 |
第6 min | 0.3 | 0.975 | 0.5 |
第8 min | 0.7 | 1.475 | 0.1 |
①反应在第2 min到第4 min时,O2的平均反应速率为________。
②反应在第6 min时改变了条件,改变的条件可能是________(填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。
4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。
A.单位时间内生成n mol NO的同时,反应n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6
E.恒压条件下,混合气体的密度不再变化
(2)2A ![]() B+C在某一温度达到平衡,若A是气态,加压平衡不移动,则B为______态。
B+C在某一温度达到平衡,若A是气态,加压平衡不移动,则B为______态。
(3)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g)平衡常数K;K的表达式__________;C(s)+H2O(g)CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)
2CO(g)平衡常数K;K的表达式__________;C(s)+H2O(g)CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=_____________;
H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=_____________;
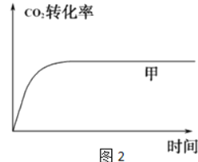
(4)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)![]() 2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象________.
2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象________.