题目内容
【题目】(1)工业制硝酸的主要反应为4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH;在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) ΔH;在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | c(NH3) (mol/L) | c(O2) (mol/L) | c(NO) (mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2 min | 0.6 | a | 0.2 |
第4 min | 0.3 | 0.975 | 0.5 |
第6 min | 0.3 | 0.975 | 0.5 |
第8 min | 0.7 | 1.475 | 0.1 |
①反应在第2 min到第4 min时,O2的平均反应速率为________。
②反应在第6 min时改变了条件,改变的条件可能是________(填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。
4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。
A.单位时间内生成n mol NO的同时,反应n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6
E.恒压条件下,混合气体的密度不再变化
(2)2A ![]() B+C在某一温度达到平衡,若A是气态,加压平衡不移动,则B为______态。
B+C在某一温度达到平衡,若A是气态,加压平衡不移动,则B为______态。
(3)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g)平衡常数K;K的表达式__________;C(s)+H2O(g)CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)
2CO(g)平衡常数K;K的表达式__________;C(s)+H2O(g)CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=_____________;
H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=_____________;
(4)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)![]() 2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象________.
2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象________.


【答案】0.1875molL-1min-1BBE气K=C(CO2)2/C(CO)K = K1/K2 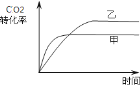
【解析】
(1)①氨气的平均化学反应速率为v=![]() =
=![]() =0.015 mol·L-1·min-1,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以氧气的平均化学反应速率为0.1875mol·L-1·min-1;
=0.015 mol·L-1·min-1,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以氧气的平均化学反应速率为0.1875mol·L-1·min-1;
②通过图表比较起始到第6min和第6min到第8min时知,反应物浓度变大和生成物浓度变小,逆向移动,所以改变的条件是升高温度;选项B正确,使用催化剂,平衡不移动,选项A错误;减小压强和增加O2的浓度,正向移动,选项C、D错误;故答案选B;
③A.单位时间内生成n mol NO的向时,生成n mol NH3,说明v正=v逆,选项A正确;B.条件一定,混合气体的平均相对分子质量不再变化,方程式两边气体的化学计量数之和不相等,气体的物质的量是个变化的量,气体的质量始终不变,所以混合气体的平均相对分子质量不变,证明正逆反应速率相等,达到了平衡状态,选项B正确;C.百分含量w(NH3)=w(NO),不能说明v正=v逆,选项C错误;D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6,不能说明v正=v逆,选项D错误;E.由于反应方程式两边气体的质量不变,容器的容积不变,所以混合气体的密度可变,因此混合气体的密度是一个变量,可以判断是否达到了平衡状态,选项E正确;答案选BE;
(2)增大化学平衡不移动,反应前后气体的物质的量相等,A是气态时,则B为气态,C为气态;
(3)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g);K的表达式为K=
2CO(g);K的表达式为K=![]() ;
;
C(s)+H2O(g)![]() CO(g)+H2(g)平衡常数K1=
CO(g)+H2(g)平衡常数K1=![]() ;
;
CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K2=
H2(g)+CO2(g)平衡常数K2=![]() ;
;
K=![]() =
=![]() ;
;
(4)C(s)+CO2(g) ![]() 2CO(g),随着反应的进行,甲中压强逐增大,而乙是恒压,故乙相对于甲而言,相当于减小压强,平衡正向移动,化学反应速率减慢,二氧化碳的转化率增大,故乙容器中CO2的转化率随时间变化的图象为:
2CO(g),随着反应的进行,甲中压强逐增大,而乙是恒压,故乙相对于甲而言,相当于减小压强,平衡正向移动,化学反应速率减慢,二氧化碳的转化率增大,故乙容器中CO2的转化率随时间变化的图象为: 。
。


