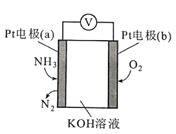
题目内容
【题目】固体X由四种元素组成,为探究其组成和性质,设计并完成如下实验:

(1)固体X中含有H、O、______和______元素。
(2)写出固体X受热分解的化学方程式______。
(3)取少量固体B溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,写出产生该现象的离子方程式______。
【答案】C Cu Cu3(OH)2(CO3)2![]() 3CuO+H2O+2CO2↑ 2Cu2++4I-=2CuI↓+I2
3CuO+H2O+2CO2↑ 2Cu2++4I-=2CuI↓+I2
【解析】
由固体隔绝空气加热生成1.8g水可知,含H原子的物质的量n=1.8g/18gmol-1×2=0.2mol,质量为0.2g;气体A与石灰水反应生成白色沉淀为碳酸钙,其物质的量n=20.0g/100gmol-1=0.2mol,所以碳原子的物质的质量为m=0.2mol×12g/mol=2.4g;固体B与CO反应生成紫红色固体为Cu,则B为CuO,其物质的量为24.0g/80gmol-1=0.3mol,所以铜的质量为m=0.3mol×64g/mol=19.6g;剩余质量为34.6g-0.2g-2.4g-19.6g=12.4g,所以X中含O为n=12.4g/16gmol-1=0.8mol,则n(Cu):n(C):n(H):n(O)=3:2:2:8,X为Cu3(OH)2(CO3)2,以此来解答。
(1)由上述分析可知,固体X中含有H、O、C、Cu元素,故答案为:C;Cu;
(2)固体X受热分解的化学方程式为Cu3(OH)2(CO3)2![]() 3CuO+H2O+2CO2↑,故答案为:Cu3(OH)2(CO3)2
3CuO+H2O+2CO2↑,故答案为:Cu3(OH)2(CO3)2![]() 3CuO+H2O+2CO2↑;
3CuO+H2O+2CO2↑;
(3)取少量固体B溶于稀硫酸,生成硫酸铜,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,可知生成碘和CuI,产生该现象的离子方程式为2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】我国煤炭资源丰富,通过煤的气化和液化。能使煤炭得以更广泛的应用。
I.先将煤转化为CO,再利用CO和水蒸气反应制取H2,反应为CO(g)+H2O(g)CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和水蒸气,800℃时测得部分数据:
t/min | 0 | 1 | 2 | 3 | 4 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.20 | 0.20 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.60 | 0.60 |
从反应开始到2min时,υ(H2)为___________________;该温度下反应的平衡常数K=__________。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol水蒸气、2molCO2、2mol H2,此时υ正____υ逆(填“>”、“<”或“=”)。
II.利用CO生产燃料甲醇(CH3OH),一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
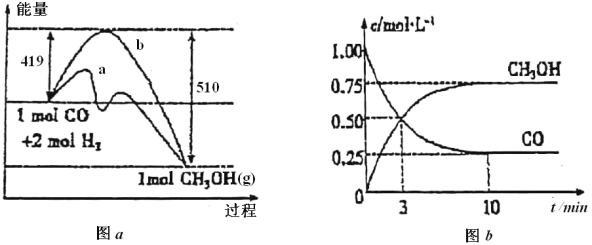
(1)在图a中,曲线_____(填“a”或“b”)表示使用了催化剂;该反应属于_______反应(填“吸热”或“放热”);若保持其他条件不变,将反应体系升温,则该反应的平衡常数将______(填“变大”、“变小”或“不变”)。
(2)下列说法正确的是_______(填序号)。
① 起始充入的CO为2mol
② 增加CO浓度,CO的转化率增大
③ 当混合气体的密度不变时,反应达到平衡
④ 保持温度和容积不变,再充入2molCO和4mol H2,再次达平衡时![]() 会减小
会减小
(3)若在相同情况下,最初向容器中充入____mol CH3OH(g),可以达到上述同样的平衡状态。
(4)请在下图中画出平衡时甲醇的百分含量随压强的变化曲线,要求画温度不同的2条曲线(在曲线上标出T1、T2且T1&t;T2)。____________
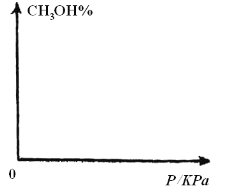 。
。
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为____mol·L-1·min-l,50 min时,v(正)____(填“<”“>”或“=”)v(逆)。
(2)0~20 min内,实验2比实验1的反应速率_____(填“快”或“慢”),其原因可能是______。
(3)实验3比实验1的反应速率____(填“快”或“慢”),其原因是____。