题目内容
(6分) 铁粉和氧化亚铁粉末的混合物共9.2克,加入到150mL的稀硫酸中,恰好完全反应,得到氢气2.24L(标准状况)。求:
(1)混合物中铁和氧化亚铁的质量?
(2)原稀硫酸的物质的量浓度?
(1)混合物中铁和氧化亚铁的质量?
(2)原稀硫酸的物质的量浓度?
⑴ Fe:5.6g FeO:3.6g 3分 ⑵ 1 mol/L 3分
n=V/Vm=0.1mol
Fe+H2SO4==FeSO4+H2 ↑
1 1
n Fe 0.1mol
所以n Fe="0.1" mol,mFe=5.6g, mFeo=9.2g-5.6g=3.6g, nFeo=0.05mol
溶质为硫酸亚铁,根据铁元素守恒n FeSO4=0.15mol,所以n H2SO4=0.15mol,C H2SO4=1 mol/L
Fe+H2SO4==FeSO4+H2 ↑
1 1
n Fe 0.1mol
所以n Fe="0.1" mol,mFe=5.6g, mFeo=9.2g-5.6g=3.6g, nFeo=0.05mol
溶质为硫酸亚铁,根据铁元素守恒n FeSO4=0.15mol,所以n H2SO4=0.15mol,C H2SO4=1 mol/L

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
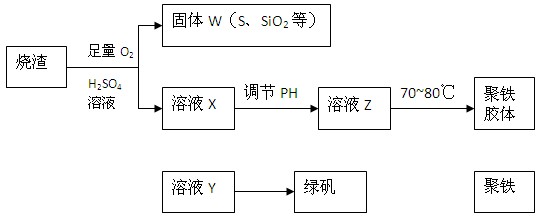
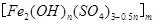 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下: