题目内容
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
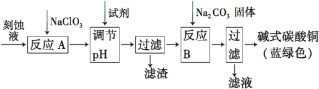
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
【答案】将Fe2+氧化为Fe3+3.7~4.7c、d水浴加热CuO2Cu2++3CO32-+2H2O====Cu2(OH)2CO3+2HCO3-取最后一次洗涤液,加入硝酸银、稀硝酸溶液,无沉淀产生则表明已洗净
【解析】
(1)利用NaClO3的强氧化性,将Fe2+氧化成Fe3+;(2)根据表格中的数据,Fe3+全部以Fe(OH)3形式沉淀出来,Cu2+不能转化成沉淀;(3)控制温度为60℃时,一般采用水浴加热;(4)利用CO32-的水解,进行判断;(5)注意产品表面的杂质。
(1)根据金属阳离子生成沉淀的pH,要除去Fe2+、Fe3+杂质,必须先将Fe2+转变为Fe3+,再调节pH,故NaClO3的作用是将Fe2+转变为Fe3+;
(2)要将Fe3+完全沉淀,但不能将Cu2+沉淀,故pH应在3.7~4.7。除杂时,不能引入新的杂质,同时促进Fe3+的水解,a、加入氨水,引入NH4+,故a错误;b、加入硫酸铜,引入SO42-,故b错误;c、加入氢氧化铜,因为氢氧化铜是难溶碱,因此不能引入新杂质,且能够调节pH,故c正确;d、加入碱式碳酸铜,碱式碳酸铜不溶于水,不引入新的杂质,且能够调节pH,故d正确;
(3)控制反应温度在100℃以下,可采用水浴加热法;碱式碳酸铜受热易分解成黑色的CuO;
(4)由信息知,反应物中有Cu2+、CO32-生成物中有碱式碳酸铜,再根据原子守恒和电荷守恒,反应的离子方程式为2Cu2++3CO32-+2H2O====Cu2(OH)2CO3+2HCO3-;
(5)沉淀上会吸附Na+、Cl-等,故可检验Cl-。注意一定要强调“最后一次”,具体操作是取最后一次洗涤液,加入硝酸银、稀硝酸溶液,无沉淀产生则表明已洗净。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,则定蛋壳中钙含量操作步骤如图12所示:
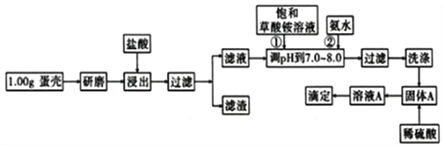
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是____________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是__________________。
(3)洗涤最好选用_____(填“冰水”或“0.1mol/L草酸铵溶液”),其目的是____________。
(4))滴定操是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸台定量关系,可间接求出钙的含量
步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化
步骤3:用00190mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1mL.
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2=20.00 |
3 | 0.0190 | V2=19.98 |
4 | 0.0190 | V4=20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为_______________________。
②滴定终点的现象是_________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_____实际值(填“>”“=”或“<”)