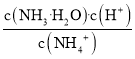题目内容
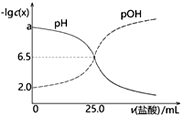
【题目】下列说法不正确的是![]()
A.![]() 的溶液不一定呈中性
的溶液不一定呈中性
B.除去氯化镁溶液中的氯化铁杂质,可加入碳酸镁调节pH
C.强碱滴定弱酸可选用酚酞作指示剂,滴定终点现象是无色突变为粉色
D.![]() 时,某溶液中由水电离产生的
时,某溶液中由水电离产生的![]() ,该溶液
,该溶液![]()
【答案】D
【解析】
A.只有在![]() 时,
时,![]() 的溶液才显中性;
的溶液才显中性;
B.加入碳酸镁能调节溶液的pH,促进铁离子水解;
C.强碱滴定弱酸达到滴定终点时,溶液呈弱碱性;
D.![]() 时,某溶液中由水电离产生的
时,某溶液中由水电离产生的![]() ,说明水的电离被抑制,根据水的电离来分析。
,说明水的电离被抑制,根据水的电离来分析。
A.只有在![]() 时,
时,![]() 的溶液才显中性,如在
的溶液才显中性,如在![]() 时,
时,![]() 的溶液显碱性,故A正确;
的溶液显碱性,故A正确;
B.加入碳酸镁能调节溶液的pH,减小溶液中的氢离子浓度,促进铁离子水解,从而除去铁离子且不引入杂质,故B正确;
C.强碱滴定弱酸达到滴定终点时,溶液呈弱碱性,故可以用酚酞做指示剂,且当滴定终点时溶液由无色变为粉红色,故C正确;
D.![]() 时,某溶液中由水电离产生的
时,某溶液中由水电离产生的![]() ,说明水的电离被抑制,而酸和碱均能抑制水的电离,故此溶液可能是酸溶液,也可能是碱溶液。 若为酸溶液,溶液中的氢氧根全部来自水的电离,则溶液中
,说明水的电离被抑制,而酸和碱均能抑制水的电离,故此溶液可能是酸溶液,也可能是碱溶液。 若为酸溶液,溶液中的氢氧根全部来自水的电离,则溶液中![]() ,
,![]() ,则
,则![]() ; 若为碱溶液,溶液中的氢离子全部来自水的电离,则溶液中的
; 若为碱溶液,溶液中的氢离子全部来自水的电离,则溶液中的![]() ,则
,则![]() ,故D错误;
,故D错误;
故选:D。

【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=______(用K1、K2表示)。
(2)反应③的ΔH____0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度相等,且均为0.1mol·L-1,则此时υ正____υ逆(填“>”、“=”或“<”)
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),测得有关数据如下:
CH3OCH3(g)+H2O(g),测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为____,
②该温度下的反应的平衡常数为____。
【题目】下列实验、现象及相关结论均正确的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30s不复原 | 出现白色沉淀 |
结论 | SO2 有强强氧化性 | 有机物中含有溴原子 | 滴定达终点 | Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D