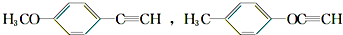题目内容
15.下列离子方程式书写正确的是( )| A. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | 碳酸钡与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气和石灰乳反应:Ca(OH)2+Cl2═Ca2++Cl-+ClO-+H2O |
分析 A.不符合反应客观事实;
B.次氯酸为弱酸,应保留化学式;
C.碳酸钡为沉淀,应保留化学式;
D.氯气和石灰乳反应生成氯化钙、次氯酸钙和水.
解答 解:A.稀 H2SO4与铁粉反应生成二价铁离子,离子方程式:2e+2H+═Fe2++H2↑,故A错误;
B.氯气和水反应,离子方程式:Cl2+H2O═Cl-+HClO+H+,故B错误;
C.碳酸钡与盐酸反应,离子方程式:BaCO3+2H+═CO2↑+H2O+Ba2+,故C错误;
D.氯气和石灰乳反应生成氯化钙、次氯酸钙和水,离子方程式:Ca(OH)2+Cl2═Ca2++Cl-+ClO-+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
相关题目
4.分类是化学学习与研究的常用方法,下列分类正确的是( )
| A. | 碱性氧化物均属于金属氧化物 | |
| B. | 根据电解质在水溶液中的导电性强弱,将电解质分为强电解质和弱电解质 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液 | |
| D. | 稀豆浆、雾、FeCl3溶液均为胶体 |
6.NA表示阿伏加德罗常数的值,下列叙述不正确的是( )


| A. | CO和N2为等电子体,22.4 L的CO气体与l mol N2所含的电子数相等 | |
| B. | 在2.4 g石墨中,含C-C共价键数目为0.3NA | |
| C. | 720 g C60晶体含有0.25NA个晶胞(晶胞如图) | |
| D. | 1mol[Cu(NH3)4]2+中含配位键4 NA |
10.下列说法正确的是( )
| A. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023个 | |
| B. | 含1 mol FeCl3的FeCl3饱和溶液完全反应可以生成1mol Fe(OH)3胶体粒子 | |
| C. | 11.2L二氧化碳气体中所含的分子数为0.5NA | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1mol |
20.在酸性的无色透明溶液中能够大量共存的是( )
| A. | NH${\;}_{4}^{+}$、Fe3+、SO42-、Cl- | B. | Mg2+、Ag+、CO32-、Cl- | ||
| C. | K+、NH4+、Cl-、SO42- | D. | K+、Na+、NO3-、HCO3- |
7.下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 使酚酞变红的溶液K+、H+、SO42-、2- | B. | 纯碱溶液K+、SO42-、OH-、NO3- | ||
| C. | 澄清石灰水Na+、Fe3+、CO2、Cl- | D. | 稀硫酸溶液Ba2+、Na+、HCO3-、NO3- |
4.把下列四种X溶液分别加进4个均盛有10mL2mol/L盐酸的烧杯中,并立即都加入水稀释至50mL,此时X和盐酸进行反应,其中反应速率最快的是( )
| A. | 20mL,2.5mol/L | B. | 30mL,2mol/L | C. | 10ml,5mol/L | D. | 20mL,2mol/L |
5.美国UNC化学教授Thomas J.Meyer等研发了环境友好、完全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物.已知10mL Na2R溶液含Na+的数目为N,该Na2R溶液的物质的量浓度为( )
| A. | N×10-2mol•L-1 | B. | $\frac{N}{1.024×1{0}^{22}}$mol•L-1 | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol•L-1 | D. | $\frac{N}{6.02×1{0}^{25}}$mol•L-1 |
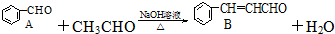
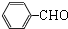 +2Cu(OH)2$\stackrel{△}{→}$c
+2Cu(OH)2$\stackrel{△}{→}$c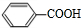 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.