题目内容
【题目】燃烧法是测定有机化合物分子式的一种方法,某有机物12g在氧气中完全燃烧,生成7.2g水和8.96LCO2(标况)。0.5mol该有机物的质量为30g。
(1)试求该有机物分子式_________________________;
(2)若该有机物能与Na2CO3溶液反应产生气体,则其结构简式为________________;
若该有机物既能与Na反应产生气体,又能发生银镜反应,则结构简式为___________。
【答案】 C2H4O2 CH3COOH HOCH2CHO
【解析】试题分析:本题是有机物分子式、结构确定的一种方法,解题基本思路是求出分子中各原子数目从而得到分子式,或者先求出最简式,再通过相对分子质量求分子式。
解析:(1)有机物完全燃烧后生成CO2和H2O,所以分子中一定含有C、H两种元素,可能含有O元素。M=30g/0.5mol=60g·mol-1,n(有)=12g/60g·mol-1=0.2mol,n(C)=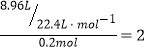 ,n(H)=
,n(H)=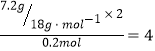 ,n(O)=
,n(O)= ![]() ,因此该有机物分子式为C2H4O2。答案:C2H4O2。(2)若该有机物能与Na2CO3反应产生气体,说明分子结构中含有—COOH,生成的气体是CO2,剩余部分为—CH3,该有机物为CH3COOH。若该有机物能与Na反应产生气体,说明分子结构中含有—OH,该有机物又能发生银镜反应,说明分子结构中含有—CHO,则该有机物为HOCH2CHO。答案:CH3COOH、HOCH2CHO。
,因此该有机物分子式为C2H4O2。答案:C2H4O2。(2)若该有机物能与Na2CO3反应产生气体,说明分子结构中含有—COOH,生成的气体是CO2,剩余部分为—CH3,该有机物为CH3COOH。若该有机物能与Na反应产生气体,说明分子结构中含有—OH,该有机物又能发生银镜反应,说明分子结构中含有—CHO,则该有机物为HOCH2CHO。答案:CH3COOH、HOCH2CHO。

练习册系列答案
相关题目