题目内容
【题目】亚氯酸钠是一种高效氧化性漂白剂。主要用于棉纺、亚麻、纸浆漂白、食品消毒、水处理、杀菌灭藻和鱼药制造。某化学兴趣小组对亚氯酸进行了研究,请回答下列问题。
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaC1。
(1)下列物质中与亚氯酸钠漂白原理相同的是_______。
A.H2O2 B.NaClO C.SO2 D.Al(OH)3胶体
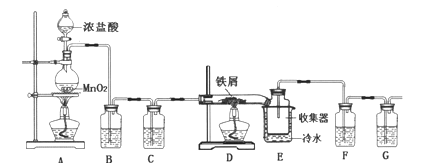
(2)现利用下图所示装置(夹持装置省略)进行制取NaClO2晶体实验。
a.装置②中两种实验仪器的名称分别是_____________、___________。
b.装置②中产生ClO2的化学方程式为_________________________。
装置④中制备NaClO2的离子方程式为________________________。
c.装置③的作用是________________。
d.未反应完的ClO2在装置⑤中可被NaOH溶液吸收,生成的氧化产物与还原产物均为含氧酸盐,且二者的物质的量之比为1:1,请写出该反应的离子方程式______________________。
e.从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55℃蒸发结晶;②趁热过滤;③___________;④低于60℃干燥,得到成品。
(3)用如下实验方案测定亚氯酸钠样品的纯度。
亚氯酸钠样品纯度测定实验用到的化学反应方程式为ClO2-+4I-+4H+=2H2O+2I2+Cl-、I2+2S2O32-=2I-+S4O62-
a.该测定实验用到的指示剂为_________________。
b.为测定亚氯酸钠样品纯度,需要用到下列实验数据中的___________(填写选项字母)
A.亚氯酸钠样品的质量(a g)
B.过量的碘化钾晶体的质量(b g)
C.稀硫酸的浓度(cmol/L)和体积(D mL)
D.指示剂的加入量(d mol)
E.标准液的浓度(e mol/L)和消耗体积(VmL)
用上述选定的数据表示出样品中NaC1O2 质量分数____________。
【答案】AB三颈烧瓶或三颈蒸馏烧瓶或三颈瓶分液漏斗2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O2OH-+2C1O2+H2O2=2ClO2-+2H2O+O2防止倒吸或安全瓶2C1O2+2OH-=ClO3-+C1O2-+H2O用38~60℃的温水洗涤淀粉溶液AE![]() %
%
【解析】(1)亚氯酸钠漂白原理是因其有强氧化性,H2O2 和NaClO有强氧化性,可作漂白剂,SO2 因与有色物质生成不稳定的无色物质,而具有漂白性,而Al(OH)3胶体只有吸附作用,能净水,但不能作漂白剂,故答案为AB;
(2)a.装置②中两种实验仪器的名称分别是三颈烧瓶或三颈蒸馏烧瓶或三颈瓶和分液漏斗;
b.装置②中利用NaClO3和Na2SO3在稀硫酸的酸化下,产生ClO2和硫酸钠,发生反应的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;
装置④中利用ClO2和H2O2在碱性条件来制备NaClO2,其中ClO2是氧化剂,H2O2的氧化产物为O2,发生反应的离子方程式为2OH-+2C1O2+H2O2=2ClO2-+2H2O+O2;
c.ClO2进入装置④,发生反应使装置内压强降低,可能发生倒吸,装置③的作用为防止倒吸;
d.C1O2中氯元素的化合价为+4价,氧化产物中氯元素为+5价,则还原产物中氯元素的化合价为+3价,发生反应的离子方程式2C1O2+2OH-=ClO3-+C1O2-+H2O;
e.从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥;
(3)a.有碘单质参和生成的反应,一般采用淀粉溶液做指示剂;
b.A.为测定亚氯酸钠样品纯度,肯定需要用到亚氯酸钠样品的质量(a g),故A正确;B.过量的碘化钾未参加反应,无需知道碘化钾晶体的质量,故B错误;C.稀硫酸只是酸化溶液,无需知道其浓度和体积,故C错误;D.指示剂只是为了判断滴定终点,无需知道其体积,故D错误;E.滴定消耗的标准液体积(VmL)及其浓度(e mol/L)可用于计算样品中亚氯酸钠的含量,故E正确;答案为AE;
根据:ClO2-~~~~~2I2~~~~~~~4S2O32-可知ClO2-的物质的量为V×10-3L×e mol/L×![]() =
=![]() Ve×10-3mol,样品中NaC1O2 质量分数
Ve×10-3mol,样品中NaC1O2 质量分数![]() ×100%=
×100%=![]() %。
%。

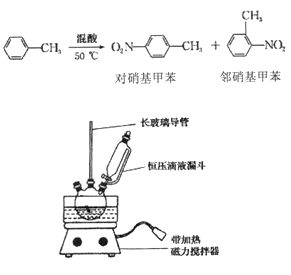
【题目】实验室制备一硝基甲笨(主要含邻硝基甲苯和对硝基甲苯)的反应原理、实验装
密度/(g·cm-3) | 沸点/℃ | 式量 | 溶解性 | |
甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
实验步骤:
① 配制混酸,组装如图反应装置。取100 mL 烧杯,用10 mL 浓硫酸与30 mL 浓硝酸配
制混酸,加入恒压滴液漏斗中,把15 mL 甲苯(折合质量13.0g)加入三颈烧瓶中。
② 向室温下的甲苯中逐滴加混酸,边滴边搅拌,混合均匀。
③ 在50一60℃ 下发生反应,直至反应结束。
④ 除去混酸后,依次用蒸馏水和10% NaCO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
请回答下列问题:
(l)配制40mL 混酸的操作是________________
(2)装置中还缺少__________(填仪器名称)。如果温度超过60℃,将会有____(填物质名称)生成。
(3)分离粗产品和水的操作方法是__________
(4)产品用10% NaCO3溶液洗涤之后,再用蒸馏水洗涤,检验产品是否洗干净的操作是_______
(5)为了得到更纯净的硝基苯,还须先向液体中加入_______除去水,然后蒸馏,若最终得到产品的质量为13.70g,则一硝基甲苯的产率是________。