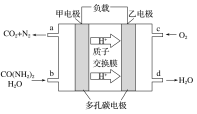
题目内容
【题目】三氧化二锰(Mn2O3)在现代工业上应用广泛。以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备高纯度硫酸锰进而制备三氧化二锰的工艺流程如下(两种矿物中均不存在单质杂质):
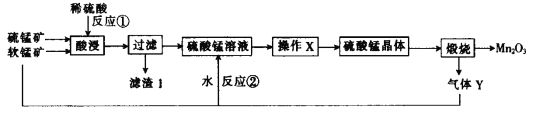
(1)MnS、Mn2O3、MnO2中锰元素的化合价均不同,已知锰有多种化合价,请再写出两种含锰且锰的化合价不同的化合物的化学式:______________。
(2)滤渣1中存在一种非金属单质,则“酸浸”时反应①的化学方程式为________________。
(3)操作X为蒸发浓缩、________、________、洗涤烘干。经操作X之后得到MnSO4H2O。在洗涤操作中,常用酒精洗涤MnSO4H2O晶体,主要目的是_______________________。
(4)气体Y直接排放会污染空气,将Y的水溶液与软锰矿反应可得硫酸锰,反应②的化学方程式为______。
(5)Mn2O3与MnO2类似,也能与浓盐酸反应,其反应的离子方程式为____________。
(6)用标准的BaCl2溶液测定样品中MnSO4H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其原因可能是_________________(任写一点)。
【答案】K2MnO4、KMnO4 MnO2+MnS+2H2SO4=2MnSO4+S+2H2O 冷却结晶 过滤 减少MnSO4H2O的损失 MnO2+SO2=MnSO4 Mn2O3+6H++2Cl-(浓)![]() 2Mn2++Cl2↑+3H2O 混有硫酸盐杂质
2Mn2++Cl2↑+3H2O 混有硫酸盐杂质
【解析】
硫锰矿、软锰矿酸浸时生成硫酸锰、单质硫,则滤渣中含有硫;滤液为硫酸锰溶液,经蒸发浓缩、冷却结晶得到硫酸锰晶体,煅烧的到Mn2O3和二氧化硫。
(1)锰元素有多种化合价,还有+6价的K2MnO4和+7价的KMnO4;
(2)滤渣1中含有硫单质,是由+3价的Mn与-2价的S反应生成,方程式为MnO2+MnS+2H2SO4=2MnSO4+S+2H2O;
(3)制取硫酸锰晶体时,需要把溶液蒸发浓缩,冷却结晶,对固液进行过滤分离,洗涤,晾干即可;用酒精洗涤可降低硫酸锰晶体的溶解度,减少损失;
(4)气体Y为二氧化硫,与二氧化锰反应生成硫酸锰,方程式为MnO2+SO2=MnSO4;
(5)已知Mn2O3的性质和MnO2类似,与浓盐酸反应生成MnCl2和氯气、水,离子方程式为Mn2O3+6H++2Cl-(浓)![]() 2Mn2++Cl2↑+3H2O;
2Mn2++Cl2↑+3H2O;
(6)质量分数大于100%,说明硫酸锰晶体中的杂质为硫酸盐或部分晶体失去结晶水,导致计算出的硫酸锰晶体的质量偏大。

【题目】某校化学实验小组在“探究碘水与FeCl2溶液能否反应”的系列实验中发现:在足量的稀KI溶液中,加入1~2滴FeCl3溶液,振荡后溶液呈黄色。
(查阅资料)
碘微溶于水,碘的水溶液颜色随浓度变化呈现黄色或棕色,碘水中含有碘单质;含Fe3+的溶液也呈黄色。
(提出问题)
Fe3+、I2的氧化性强弱情况。
(提出猜想)
(1)甲同学认为氧化性I2>Fe3+,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含______;乙同学认为氧化性Fe3+>I2,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含_______。
(设计实验并验证)
(2)为验证乙同学的观点正确,丙同学选用下面所提供的试剂设计出以下两种方案进行实验,请完成下列表格。供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
试剂 | 实验现象 | |
方案1 | ____________ | ______ |
方案2 | ______ | _________ |
(实验结论)
氧化性:Fe3+>I2。
(拓展应用)
(3)①根据上述实验推测,若在FeI2溶液中通入氯气,首先被氧化的离子是________。
②在100mL FeI2溶液中通入2.24LCl2(标准状况下),溶液中若有![]() 的Fe2+ 被氧化,用离子方程式表示该反应过程:___。
的Fe2+ 被氧化,用离子方程式表示该反应过程:___。