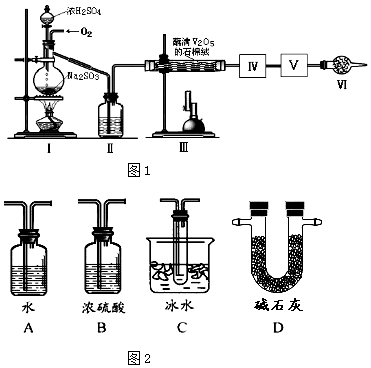
��Ŀ����
����Ŀ����ҵ�����в�����SO2��NOֱ���ŷŽ��Դ������������Ⱦ�����õ绯ѧԭ������SO2��NO��ͬʱ���Na2S2O4��NH4NO3��Ʒ�Ĺ�������ͼ���£�CeΪ��Ԫ�أ��� 
��ش��������⣮
��1��װ�â���NO����������������NO2�������ӷ���ʽ ��
��2�����������H2SO3��HSO3����SO32����������SO2��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�������������ҺpH�Ĺ�ϵ��ͼ1��ʾ�� 
������˵����ȷ���������ţ���
A��pH=7ʱ����Һ��c��Na+����c��HSO3����+c��SO32����
B����ͼ�����ݣ����Թ����H2SO3�ĵڶ�������ƽ�ⳣ��Ka2��10��7
C��Ϊ��þ����ܴ���NaHSO3 �� Ӧ����Һ��pH������4��5Ϊ��
D��pH=9ʱ����Һ��c��OH����=c��H+��+c��HSO4����+c��H2SO4��
����1L1mol/L��NaOH��Һ��ȫ����13.44L������£�SO2 �� ��Ӧ�����ӷ���ʽΪ ��
��ȡװ�â��е�����ҺvmL����cmol/L�����Ը��������Һ�ζ������Ը��������ҺӦװ�������ʽ����ʽ�����ζ����У��жϵζ��յ�ķ����� ��
��3��װ�â������֮һ������Ce4+ �� ��ԭ����ͼ2��ʾ�� ͼ��AΪ��Դ��������������������Ҳ෴Ӧ���з�������Ҫ�缫��ӦʽΪ ��
��4����֪����װ�â�����Һ��NO2����Ũ��Ϊ0.4mol/L��Ҫʹ1m3����Һ�е�NO2����ȫת��ΪNH4NO3 �� ��������װ�â���ͨ���״���µ�O2�����ΪL��
���𰸡�
��1��NO+H2O+Ce4+=Ce3++NO2��+2H+
��2��ABC��3SO2+5OH��=2SO32��+HSO3��+2H2O����ʽ���������һ����Һ���Ϻ�ɫ�Ұ������ɫ����
��3�������������һ����Һ���Ϻ�ɫ�Ұ������ɫ����
��4��4480
���������⣺װ�â��ж�������������������ܺ�ǿ����������֮�䷢����Ӧ��SO2+OH��=HSO3�� �� NO����������֮�䲻�ᷴӦ��װ�â���NO�����������£�NO��Ce4+֮��ᷢ��������ԭ��Ӧ��NO+H2O+Ce4+=Ce3++NO2��+2H+ �� NO+2H2O+3Ce4+=3Ce3++NO3��+4H+ �� װ�â��У��ڵ��۵�����2Ce3+��2e��=2Ce4+ �� �����缫��ӦʽΪ��2HSO3��+2H++2e��=S2O42��+2H2O��װ�â���ͨ�백����������2NO2��+O2++2H++2NH3=2NH4++2NO3�� �� ��1��װ�â���NO������������NO��Ce4+֮��ᷢ��������ԭ��Ӧ��NO+H2O+Ce4+=Ce3++NO2��+2H+ �� NO+2H2O+3Ce4+=3Ce3++NO3��+4H+ �� ���Դ��ǣ�NO+H2O+Ce4+=Ce3++NO2��+2H+����2����A��pH=7ʱ����Һ�����ԣ�c��H+��=c��OH��������Һ�д��ڵ���غ㣺c��H+��+c��Na+��=c��HSO3����+2c��SO32����+c��OH����������Һ��c��Na+��=c��HSO3����+2c��SO32��������A��ȷ��
B��HSO3��SO32��+H+ �� ��ͼ�����ݣ�pH=7ʱ��c��HSO3�� ��=c��SO32�� ������Ka�ı���ʽ��֪��H2SO3�ĵڶ�������ƽ�ⳣ��K2��c��H+��=10��7 �� ��B��ȷ��
C����Һ��pH������4��5ʱ��c��HSO3�� ��Ũ�������Ϊ��þ����ܴ���NaHSO3 �� �ɽ���Һ��pH������4��5���ң���C��ȷ��
D����Һ���������غ㣬ӦΪc��OH����=c ��H+��+c��HSO3����+2c��H2SO3������D����
���Դ��ǣ�ABC����1L1.0mol/L��NaOH��Һ�к����������Ƶ����ʵ���Ϊ��1L��1.0mol/L=1.0mol��13.44L������£�SO2 �� n��SO2��= ![]() =0.6mol��
=0.6mol��
�跴Ӧ�����������Ƶ����ʵ���Ϊx�����Ķ�����������ʵ���Ϊy
2NaOH+ | SO2�T | Na2SO3+H2O |
2 | 1 | 1 |
1.0mol | y | x |
![]() =
= ![]() =
= ![]() ��ã�x=0.5mol y=0.5mol���������������֪�������������ǹ����ģ�ʣ��Ķ�����������ʵ���Ϊ��0.6mol��0.5mol=0.1mol
��ã�x=0.5mol y=0.5mol���������������֪�������������ǹ����ģ�ʣ��Ķ�����������ʵ���Ϊ��0.6mol��0.5mol=0.1mol
���Զ������������ɵ��������Ƽ�����Ӧ��
�������������Ƶ����ʵ���Ϊa���������������Ƶ����ʵ���Ϊb
Na2SO3+H2O+ | SO2�T | 2NaHSO3 |
1 | 1 | 2 |
a | 0.1mol | b |
![]() =
= ![]() =
= ![]() ��ã�a=0.1mol b=0.2mol��
��ã�a=0.1mol b=0.2mol��
����Һ��n��SO32����=0.5mol��0.1mol=0.4mol��n��HSO3����=0.2mol��n��SO32������n��HSO3����=2��1����Ӧ�����ӷ���ʽΪ3SO2+5OH��=2SO32��+HSO3��+2H2
���Դ��ǣ�3SO2+5OH��=2SO32��+HSO3��+2H2O��
����ʽ�ζ���ֻ��ʢ��������Һ����ʽ�ζ���ֻ��ʢ�ż�����Һ�����Ը��������Һ�����ԣ������ʢ������ʽ�ζ����У�ԭ��Һ��ɫ����KMnO4Ϊ�Ϻ�ɫ�����Ե���Һ�е�H2C2O4��KHC2O4��Ӧ��ȫʱ���������һ����Һ���Ϻ�ɫ�Ұ������ɫ���䣻
���Դ��ǣ���ʽ���������һ����Һ���Ϻ�ɫ�Ұ������ɫ���䣻��3������Ce4+Ϊ������Ӧ�������������ϣ��������ʱ���ɵ�Ce4+�ڵ��۵����������ӵ�Դ��������Ӧ����HSO3������ԭ��S2O42�� �� �õ����ӣ��缫��ӦʽΪ��2HSO3��+2H++2e��=S2O42��+2H2O��
���Դ��ǣ�����2HSO3��+2H++2e��=S2O42��+2H2O����4��NO2����Ũ��Ϊ0.4mol/L��Ҫʹ1m3����Һ�е�NO2����ȫת��ΪNH4NO3 �� ��ʧȥ������Ϊ��1000����5��3����0.4mol�������ı���������������V�����ݵ����غ㣺 ![]() ��4=1000����5��3����0.4mol�����V=4480L��
��4=1000����5��3����0.4mol�����V=4480L��
���Դ��ǣ�4480��