题目内容
【题目】在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率.某研究小组用图1装置模拟生产过程中测定SO2转化成SO3的转化率.已知SO3的熔点是16.8℃,沸点是44.8℃.发生装置中所涉及反应的化学方程式为:Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O 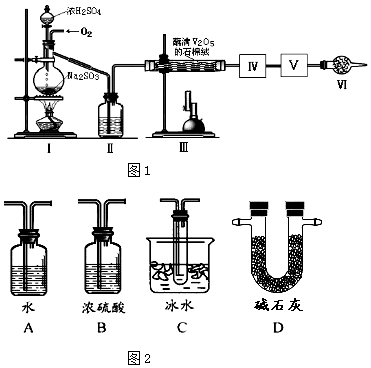
(1)Ⅱ中的试剂是,仪器Ⅵ的名称为 .
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置.请从图2A~D装置中选择最适合装置并将其序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是、 .
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先后(填编号).
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 .
(5)用12.6gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了4.48g,则实验测得SO2的转化率为 .
【答案】
(1)分别为浓硫酸、干燥管
(2)C;D
(3)②;①
(4)SO3易挥发,极易溶于水
(5)30%
【解析】解:(1)SO2转化成SO3之前必须对二氧化硫进行干燥,可以用浓硫酸,根据仪器的结构知道仪器Ⅵ的名称为干燥管, 所以答案是:浓硫酸;干燥管;(2)SO3的熔点是16.8℃,沸点是44.8℃,当温度低于 16.8℃时,三氧化硫以晶体状态存在,二氧化硫、三氧化硫的尾气处理用烧碱溶液吸收,
所以答案是:C、D;(3)为保证产生的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再滴入浓硫酸,
所以答案是:②①;(4)SO3易挥发,极易溶于水生成硫酸成大量的白雾,
所以答案是:SO3易挥发,极易溶于水;(5)根据元素守恒Na2SO3~SO2 , 则12.6gNa2SO3(即0.1mol)会生成二氧化硫0.1mol,装置Ⅴ增重了4.48g,说明剩余的二氧化硫为4.48g(即0.07mol),所以二氧化硫的转化率= ![]() ×100%=30%,
×100%=30%,
所以答案是:30%.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案