题目内容
15.下列溶液中溶质的物质的量浓度为1mol•L-1的是( )| A. | 将40 g NaOH溶解于1 L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4 L HCl 气体溶于水配成1 L的盐酸溶液 | |
| C. | 将1 L 10 mol/L的浓盐酸与水混合配成10 L溶液 | |
| D. | 从1000 mL 1 mol/L NaCl溶液中取出100 mL的溶液 |
分析 A.体积指溶液体积不是溶剂体积;
B.根据温度、压强对气体摩尔体积的影响;
C.根据C=nV解题;
D.根据溶液浓度的均一性判断.
解答 解:A.体积指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A错误.
B.气体摩尔体积受温度和压强的影响,温度越高,气体摩尔体积越大,标况下,22.4LHCl的物质的量是1mol,常温常压下,22.4LHCl的物质的量小于1mol,所以常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液的物质的量浓度不是1mol/L,故B错误.
C.将1L 10mol/L的浓盐酸与水混合配成10L溶液,溶质浓度为1mol/L,故C正确;
D.溶液的物质的量浓度有均一性,与取出溶液的体积大小无关,从1000mL 1mol/L NaCl溶液中取出100mL的溶液,溶质浓度为1mol/L,故D正确.
故选CD.
点评 本题考查了有关物质的量浓度的问题,难度不大,注意溶液的浓度有均一性,与取出溶液的体积大小无关.

练习册系列答案
相关题目
5.下列表示物质结构的化学用语或模型正确的是( )
| A. | 羟基的电子式: | B. | 溴乙烷的电子式: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | CH4分子的球棍模型: |
6.下列措施可以提高燃料燃烧效果的是( )
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入足量的空气⑤提高燃料的着火点 ⑥降低燃料的着火点.
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入足量的空气⑤提高燃料的着火点 ⑥降低燃料的着火点.
| A. | ①②③④ | B. | ②③⑤⑥ | C. | ③④⑤⑥ | D. | ①②③④ |
3.在一定温度的体积一定的密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量.
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量.
| A. | ②③⑤⑥⑦ | B. | ①②③⑥⑦ | C. | ②③④⑤⑥ | D. | ①③④⑤⑦ |
10.下列化学方程式中,不可以用H++OH-═H2O表示的是( )
| A. | 2NaOH+H2SO4═Na2SO4+2H2O | B. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | ||
| C. | Ca(OH)2+2HNO3═Ca(NO3)2+2H2O | D. | KOH+HCl═KCl+H2O |
12.蛋白质发生的下列过程中,可逆的是( )
| A. | 加入浓硫酸 | B. | 煮熟 | C. | 变性 | D. | 盐析 |
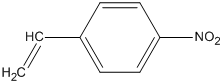
 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.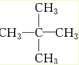 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.