题目内容
【题目】合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足导致的饥饿和死亡问题,这也充分说明了含氮化合物对人类生存的巨大意义。回答下列问题
(1)工业上用氢气和氮气直接合成氨,写出反应的化学方程式_______________。氨气极易溶于水,水溶液显 _____性,能使酚酞溶液变____色,使湿润的红色石蕊试纸变_____色。
(2)氮的氧化物有多种,一氧化氮和二氧化氮都是大气污染物。氨气在催化剂作用下可被氧化生成一氧化氮,一氧化氮气体与空气变___色,原因是__________(用化学方程式表示);二氧化氮易溶于水并与水反应,此反应的氧化剂是_______,还原剂是______,氧化剂和还原剂的质量之比为______
【答案】N2+3H2![]() 2NH3 碱 红 蓝 红棕色 2NO+O2==2NO2 NO2 NO2 1:2
2NH3 碱 红 蓝 红棕色 2NO+O2==2NO2 NO2 NO2 1:2
【解析】
(1)工业上用氢气和氮气直接合成氨,反应的化学方程式为N2+3H2![]() 2NH3;氨气极易溶于水,水溶液显碱性,能使酚酞溶液变红色,使湿润的红色石蕊试纸变蓝色;
2NH3;氨气极易溶于水,水溶液显碱性,能使酚酞溶液变红色,使湿润的红色石蕊试纸变蓝色;
(2)氮的氧化物有多种,一氧化氮和二氧化氮都是大气污染物。氨气在催化剂作用下可被氧化生成一氧化氮,一氧化氮气体与遇空气变红棕色,原因是2NO+O2==2NO2;二氧化氮易溶于水并与水反应,此反应中氮元素由+4价变为+2价,故氧化剂是NO2,氮元素也从+4价变为+5价,故还原剂是NO2,氧化剂和还原剂的质量之比为1:2。

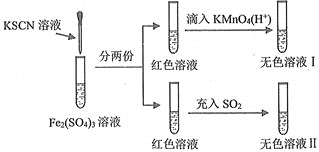
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
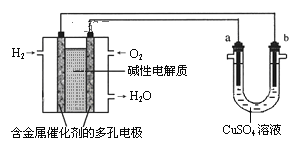
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
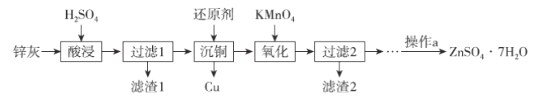
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g | 起始滴定管读数/mL | 终点滴定管读数/mL |
0.1692 | 0.20 | 26.50 |
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。