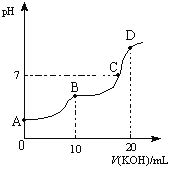
题目内容
【题目】下列一句话中叙述了两个值,前者记为![]() ,后者记为
,后者记为![]() ,
,![]() 和
和![]() 的关系从A、B、C、D中选择,并填空。
的关系从A、B、C、D中选择,并填空。
A.![]() B.
B.![]() C.
C.![]() D.无法比较
D.无法比较
(1)常温下![]() 的
的![]() 与
与![]()
![]() 等体积混合后溶液中
等体积混合后溶液中![]() 和
和![]() :______;
:______;
(2)同温度下,![]()
![]() 溶液中
溶液中![]() 水解百分率与
水解百分率与![]() 溶液中
溶液中![]() 的水解百分率:______;
的水解百分率:______;
(3)pH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的![]() 倍和
倍和![]() 倍,稀释后两溶液的
倍,稀释后两溶液的![]() 值仍然相同,则
值仍然相同,则![]() 和
和![]() 的关系是:______;
的关系是:______;
(4)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中![]() :______;
:______;
(5)相同温度下,![]() 值为12的烧碱溶液中水的电离度和
值为12的烧碱溶液中水的电离度和![]() 值为12的
值为12的![]() 溶液中水的电离度:______;
溶液中水的电离度:______;
(6)将![]() 值为2的盐酸和醋酸都稀释相同倍数所得稀溶液的
值为2的盐酸和醋酸都稀释相同倍数所得稀溶液的![]() 值:______;
值:______;
(7)室温下某强酸和某强碱溶液等体积混合后,溶液的![]() 值为7,原酸溶液和原碱溶液的物质的量浓度:______;
值为7,原酸溶液和原碱溶液的物质的量浓度:______;
(8)相同温度下,![]() 的
的![]() 溶液中的
溶液中的![]() 个数和
个数和![]()
![]() 溶液中
溶液中![]() 的个数:______。
的个数:______。
【答案】B B A B B A D A
【解析】
(1)醋酸和醋酸钠的混合液中,醋酸的电离程度大于醋酸根的水解程度,导致溶液显示酸性,c(H+)>c(OH-),根据电荷守恒,所以c(Na+)<c(CH3COO-);
因此,本题正确答案是:B;
(2)溶液越稀,即浓度越小,铁离子的水解程度越大,所以0.1mol/LFeCl3溶液中Fe3+水解百分率小于0.01molL-1FeCl3溶液中Fe3+的水解百分率;
因此,本题正确答案是:B;
(3)醋酸是弱酸,稀释促进电离,在体积增大导致浓度减小的同时还会电离出一部分氢离子,盐酸是强酸,稀释过程中体积增大而导致浓度减小,pH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的pH值仍然相同,则醋酸加水多;
因此,本题正确答案是:A;
(4)碳酸钠溶液中,碳酸根的水解程度随着温度的升高而增大,所以升高温度促进水解,碳酸氢根的浓度增大,故答案为:B;
(5)NaOH电离出OH-抑制水的电离,pH值为12的烧碱溶液中水电离出的氢离子浓度等于溶液中氢离子浓度;醋酸钠电离出的醋酸根水解促进水的电离,pH值为12的CH3COONa溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,所以相同温度下,pH值为12的烧碱溶液中水的电离度小于pH值为12的CH3COONa溶液中水的电离度;
因此,本题正确答案是:B;
(6)醋酸是弱酸,稀释促进电离,盐酸是强酸,稀释过程浓度减小,所以将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值是盐酸的大于醋酸的;
因此,本题正确答案是:A;
(7)室温下强酸和强碱溶液等体积混合后,溶液的pH值为7,则溶液显示中性,所以原来溶液中氢离子和氢氧根离子的物质的量浓度是相等的,但是酸和碱的元数未知,酸和碱的浓度大小不能确定;
因此,本题正确答案是:D;
(8)两溶液体积相等,前者物质的量浓度大于后者,氯化铵溶液中,铵根离子水解,铵根离子浓度越大水解程度越小,即相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数大于1L 0.5molL-1NH4Cl溶液中NH4+的个数;
因此,本题正确答案是:A;

【题目】下列实验操作、现象及结论均正确的是
实验操作、现象 | 结论 | |
A | 取1 mL 20%的蔗糖溶液,加入3~5滴稀硫酸。水浴加热5 min后取少量溶液,加入少量新制Cu(OH)2,加热,无砖红色沉淀产生 | 蔗糖没有发生水解 |
B | 向装有溴水的分液漏斗中加入裂化汽油,充分振荡并静置,下层为橙色 | 裂化汽油可以萃取溴 |
C | 将SO2通入紫色石蕊溶液中,溶液先变红后褪色 | SO2是酸性氧化物,还具有漂白性 |
D | 分别向盛有KI3溶液的a、b试管中滴加淀粉溶液、AgNO3溶液,a中溶液变蓝,b中产生黄色沉淀 | 溶液中存在:I3- |
A. AB. BC. CD. D