题目内容
某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
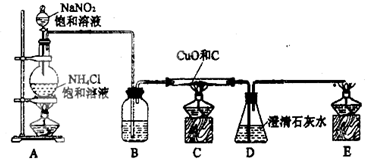
利用下图1所示装置探究NO2能否被NH3还原(K1,K2为止水夹.夹持固定装置略去)
(1)E装置中制取NO2反应的离子方程式是 。
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取 。
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(4)实验过程中气密性良好,但未能观察到C装置中的预期现象。该小组同学分析其原因可能是:
①;还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③ 。
(5)此实验装置存在一个明显的缺陷是 。
(6)为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2。另选F装置(如图2所示),重新组装,进行实验。装置的合理连接顺序是____。实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为________________________________。
(14分)(1)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O(2分) (2)a(2分)
(3)C装置中混合气体颜色变浅(其它合理答案酌情给分)(2分)
(4)在此条件下,该反应的化学反应速率极慢(未使用催化剂、未加热等答案合理即给分)(2分)
(5)缺少尾气吸收装置(2分)
(6)EDBF或FBDE(2分);2NO2+Na2O2=2NaNO3(2分)
【解析】
试题分析:(1)浓硝酸具有强氧化性,能和铜反应生成硝酸铜、二氧化氮和水,反应的离子方程为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O。
(2)a、加热NH4HCO3时,碳酸氢铵分解生成氨气、水和二氧化碳,除去水和二氧化碳就可以得到氨气,故a正确;b、加热NH4Cl时,氯化铵分解生成氨气和氯化氢,但温度降低后,氨气和氯化氢又反应生成氯化铵,所以得不到氨气,故b不正确;c、浓氨水是液体,试管中的药品是固体,所以不符合要求,故c不正确,答案选a。
(3)二氧化氮是红棕色气体,如果能被氨气还原,生成无色气体氮气,则C装置中混合气体颜色变浅。
(4)未能观察到C装置中的预期现象,这说明反应未能发生或发生的反应物很少,因此造成未能观察到C装置中的预期现象可能原因是:在此条件下,该反应的化学反应速率极慢或未使用催化剂或未加热或NO2的转化率极低导致反应现象变化不明显。
(5)二氧化氮是有毒气体,氨气是有刺激性气味的气体,所以都不能直接排空,要进行尾气处理才能排空。
(6)验证过氧化钠和二氧化氮反应,首先要用E装置制取二氧化氮,因为制取的二氧化氮气体中含有水蒸气,水能和过氧化钠反应而造成干扰,所以要用D装置除去水蒸气,然后较纯净的二氧化氮通过B装置,未反应的二氧化氮有毒不能直接排空,所以最后要进行尾气处理,选用图2装置处理尾气,所以装置的合理连接顺序是EDBF或FBDE ;B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成,过氧化钠作氧化剂,则二氧化氮中氮元素失电子化合价升高而作还原剂,所以氮元素只能转化为+5价,且生成物是纯净物,所以是硝酸钠,因此反应的化学方程式为2NO2+Na2O2=2NaNO3。
考点:考查硝酸与铜的反应;氨气制备;NO2的性质;实验方案设计与评价;尾气处理以及氧化还原反应的有关判断和应用等

 阅读快车系列答案
阅读快车系列答案
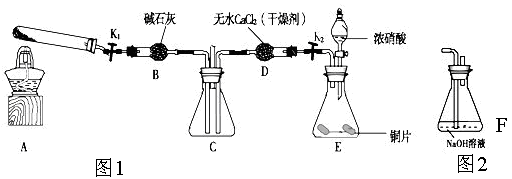
Ⅰ.(1)实验开始时先打开活塞K持续通入N2一段时间后,并闭K。将铜丝(足量)下移伸入浓硝酸后,有大量的红棕色气体生成,随时间的进行,气体颜色逐渐变浅,当A中充满无色气体时:
①装置A中反应的离子方程式为___________________________。
②接下来的实验操作是___________________________________。
(2)本实验中装置A的优点是____________________________。
Ⅱ.将B中所得溶液稀释至200 mL,用0.20 mol/L的NaOH溶液进行滴定。实验数据如下(硝酸的挥发分解及溶液体积的变化忽略不计):
实验编号 | 待测液体积(mL) | NaOH溶液体积(mL) |
1 | 20.00 | 15.98 |
2 | 20.00 | 14.99 |
3 | 20.00 | 15.01 |
(1)待测液的浓度为____________mol/L。
(2)硝酸与铜反应主要生成NO时硝酸的浓度不大于____________mol/L。