题目内容
“蛇纹石石棉”主要成分有二氧化硅、氧化镁和结晶水,它的化学式是Mg6[(OH)4Si2O5]2.
(1)“蛇纹石石棉”的氧化物形式为 ,其中原子半径最大的元素在周期表中的位置是 .
(2)Si原子的最外层的电子排布式为 ,SiO2与NaOH溶液反应的化学方程式为 .
(3)SiCl4比SiO2的熔点 (填“低”、“高”),原因是 .
(4)从哪些方面不能判断Si和O的非金属性强弱 .
A.利用Si和O在周期表中的位置
B.SiO2与水不发生反应
C.Si在一定条件下与氧气反应,生成SiO2D.H2SiO3的酸性比H2O的酸性强.
(1)“蛇纹石石棉”的氧化物形式为
(2)Si原子的最外层的电子排布式为
(3)SiCl4比SiO2的熔点
(4)从哪些方面不能判断Si和O的非金属性强弱
A.利用Si和O在周期表中的位置
B.SiO2与水不发生反应
C.Si在一定条件下与氧气反应,生成SiO2D.H2SiO3的酸性比H2O的酸性强.
考点:含硅矿物及材料的应用,非金属在元素周期表中的位置及其性质递变的规律,原子核外电子排布,硅和二氧化硅
专题:碳族元素
分析:(1)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMO?nSiO2?mH2O);这几种元素中,原子半径最大的元素是Mg元素,镁原子核外有3个电子层、最外层电子数是2;
(2)根据原子核外电子排布规律分析;SiO2与NaOH溶液反应生成硅酸钠和水;
(3)熔点的一般规律:原子晶体>离子晶体>分子晶体;
(4)A.元素在周期表中的位置可以确定其金属性、非金属性强弱;
B.SiO2与水不发生反应,不能判断Si和O的非金属性强弱;
C.Si在一定条件下与氧气反应,生成SiO2,根据化合价判断;
D.H2SiO3的酸性比H2O的酸性强,不能判断Si和O的非金属性强弱.
(2)根据原子核外电子排布规律分析;SiO2与NaOH溶液反应生成硅酸钠和水;
(3)熔点的一般规律:原子晶体>离子晶体>分子晶体;
(4)A.元素在周期表中的位置可以确定其金属性、非金属性强弱;
B.SiO2与水不发生反应,不能判断Si和O的非金属性强弱;
C.Si在一定条件下与氧气反应,生成SiO2,根据化合价判断;
D.H2SiO3的酸性比H2O的酸性强,不能判断Si和O的非金属性强弱.
解答:
解:(1)硅酸盐改写成氧化物形式时:活泼的金属氧化物写在前面,再写SiO2,含有氢元素的H2O最后写,Mg6[(OH)4Si2O5]2可表示为:6MgO?4SiO2?4H2O,这几种元素中,原子半径最大的元素是Mg元素,镁原子核外有3个电子层、最外层电子数是2,所以镁位于第三周期第IIA族,
故答案为:6MgO?4SiO2?4H2O;第三周期第IIA族;
(2)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的最外层电子排布式为3s23p2;SiO2为酸性氧化物,与NaOH溶液反应生成硅酸钠和水,反应方程式为SiO2+2NaOH=Na2SiO3+H2O;
故答案为:3s23p2;SiO2+2NaOH=Na2SiO3+H2O;
(3)熔点的一般规律:原子晶体>离子晶体>分子晶体,SiCl4为分子晶体,晶体中主要作用力为较弱的分子间作用力,SiO2为原子晶体,晶体中的作用力为共价键,所以熔点:SiO2>SiCl4,
故答案为:低;SiCl4为分子晶体,晶体中主要作用力为较弱的分子间作用力,SiO2为原子晶体,晶体中的作用力为共价键;
(4)A.根据元素在周期表中的位置结合元素周期律可以确定其金属性、非金属性强弱,同一周期从左向右,非金属性增强,故A正确;
B.SiO2与水不发生反应,不能判断Si和O的非金属性强弱,故B错误;
C.Si在一定条件下与氧气反应,生成SiO2,由于氧元素的非金属性强,所以为负价,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以元素最高价氧化物的水化物酸性强弱可以比较非金属性强弱,因氧元素无最高价氧化物的水化物,所以H2SiO3的酸性比H2O的酸性强,无法比较Si和O的非金属性强弱,故D错误;
故选BD.
故答案为:6MgO?4SiO2?4H2O;第三周期第IIA族;
(2)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的最外层电子排布式为3s23p2;SiO2为酸性氧化物,与NaOH溶液反应生成硅酸钠和水,反应方程式为SiO2+2NaOH=Na2SiO3+H2O;
故答案为:3s23p2;SiO2+2NaOH=Na2SiO3+H2O;
(3)熔点的一般规律:原子晶体>离子晶体>分子晶体,SiCl4为分子晶体,晶体中主要作用力为较弱的分子间作用力,SiO2为原子晶体,晶体中的作用力为共价键,所以熔点:SiO2>SiCl4,
故答案为:低;SiCl4为分子晶体,晶体中主要作用力为较弱的分子间作用力,SiO2为原子晶体,晶体中的作用力为共价键;
(4)A.根据元素在周期表中的位置结合元素周期律可以确定其金属性、非金属性强弱,同一周期从左向右,非金属性增强,故A正确;
B.SiO2与水不发生反应,不能判断Si和O的非金属性强弱,故B错误;
C.Si在一定条件下与氧气反应,生成SiO2,由于氧元素的非金属性强,所以为负价,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以元素最高价氧化物的水化物酸性强弱可以比较非金属性强弱,因氧元素无最高价氧化物的水化物,所以H2SiO3的酸性比H2O的酸性强,无法比较Si和O的非金属性强弱,故D错误;
故选BD.
点评:本题考查了硅酸盐改写氧化物的方法、以硅元素为载体考查了核外电子排布式、原子晶体的熔点与原子半径的关系、非金属性强弱的比较等知识点,易错题为(4)题,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
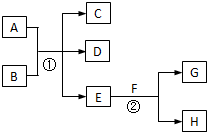
已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,A
B
C
D且D为强电解质(其它相关物质可能省略)下列说法不正确的是( )
| O2 |
| O2 |
| H2O |
| A、若A为非金属单质,则它与Mg反应的产物,其阴阳离子个数比可能为2:3 |
| B、若A为非金属单质,则其元素在周期表中的位置可能处于第二周期第IVA族 |
| C、不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化 |
| D、若A是共价化合物,O.1mol的A分子中含有的电子数可能为NA(NA为阿佛加德罗常数的值) |
下列说法正确的是( )
| A、煤中含有苯和甲苯,可用分馏的方法把它们分离出来 |
| B、C7H16的烷烃中,含有3个甲基的同分异构体有2种 |
| C、碳原子数小于或等于8的单烯烃中,与HBr加成产物只有一种结构,符合条件的单烯烃有6种 |
| D、某烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 |
 在如图各变化中,E为无色无味的液体(常温下),F为银白色金属,在空气中燃烧生成淡黄色固体,G为常见的无色气体(反应条件均已省略).回答下列问题:
在如图各变化中,E为无色无味的液体(常温下),F为银白色金属,在空气中燃烧生成淡黄色固体,G为常见的无色气体(反应条件均已省略).回答下列问题: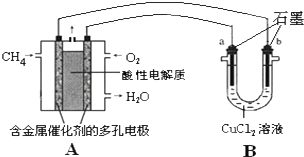 (1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染.
(1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染.