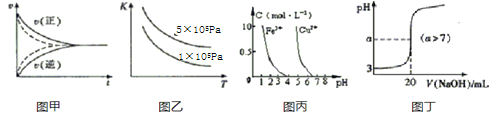
题目内容
【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。

【答案】1s22s22p63s23p64s1 ![]() < 大于 sp3 与Ca2+、Sr2+相比,钡离子由于半径大和氧离子结合更难, 所以碳酸钡分解温度高 PCl4+ PCl6- d3·ρ·10-30
< 大于 sp3 与Ca2+、Sr2+相比,钡离子由于半径大和氧离子结合更难, 所以碳酸钡分解温度高 PCl4+ PCl6- d3·ρ·10-30 ![]()
【解析】
(1)根据核外电子排布规律书写基态钾原子的电子排布和氮原子的价电子排布图;
(2)金属元素第一电离能较小,非金属元素第一电离能较大;
(3)根据相似相溶原理确定溶解度,根据白磷分子结构确定![]() 分子中原子轨道杂化类型;
分子中原子轨道杂化类型;
(4)根据阳离子半径,推测碳酸钡分解温度最高的原因;
(5)结合等电子体原理,推断与![]() 、
、![]() 互为等电子体的A、B两种离子的符号;
互为等电子体的A、B两种离子的符号;
(6)分析晶胞结构,结合“均摊法”及晶胞边长、密度计算晶胞的质量及NA。
(1)![]() 的核电荷数是20,由排布规律可知其核外电子排布式为
的核电荷数是20,由排布规律可知其核外电子排布式为![]() ,
,![]() 的价电子数为5,根据洪特规则其价电子排布图为
的价电子数为5,根据洪特规则其价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)![]() 是非金属,
是非金属,![]() 是金属,故
是金属,故![]() 的第一电离能小于
的第一电离能小于![]() ,故答案为:<;
,故答案为:<;
(3)白磷![]() 和
和![]() 均是非极性分子,水是极性分子,根据相似相溶原理可知白磷在
均是非极性分子,水是极性分子,根据相似相溶原理可知白磷在![]() 中的溶解度比在水中大;
中的溶解度比在水中大;![]() 分子结构类似于白磷
分子结构类似于白磷![]() ,故
,故![]() 中的氮原子形成3个共价单键,有1对孤对电子,故采取
中的氮原子形成3个共价单键,有1对孤对电子,故采取![]() 杂化,故答案为:大于;
杂化,故答案为:大于;![]() ;
;
(4)三种阳离子中![]() 的半径最大,与氧离子结合最难,故碳酸钡的分解温度最高,
的半径最大,与氧离子结合最难,故碳酸钡的分解温度最高,
故答案为:与![]() 相比,钡离子由于半径大和氧离子结合更难, 所以碳酸钡分解温度高;
相比,钡离子由于半径大和氧离子结合更难, 所以碳酸钡分解温度高;
(5)晶体为氯化铯型,故A、B离子数之比是1:1, A与![]() 互为等电子体,故A为
互为等电子体,故A为![]() B与
B与![]() 互为等电子体,故B为
互为等电子体,故B为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(6)金属钙是面心立方最密堆积,每个晶胞中含有钙原子数为![]() ,晶胞边长为
,晶胞边长为![]() ,则晶胞的体积为
,则晶胞的体积为![]() ,又知钙的密度是
,又知钙的密度是![]() ,故每个晶胞的质量为
,故每个晶胞的质量为![]() ,每个晶胞含有4个钙原子,故
,每个晶胞含有4个钙原子,故![]() ,则
,则![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案【题目】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(C—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。
相关化学键的键能如下表所示:
化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)为研究汽车尾气转化为无毒无害的物质的有关反应,在某恒容密闭容器中充入4molCO和4 mol NO,发生反应2CO+2NO![]() 2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
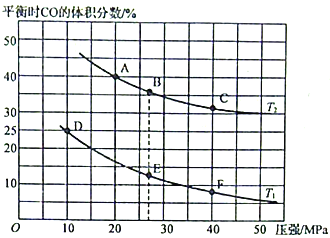
①该可逆反应达到平衡后,为在提高反应速率的同时提高NO的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入CO和NO b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②由图可知,压强为20MPa、温度为T2下的平衡常数Kp=___________MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。保留4位小数)。
③若在B点对反应容器降低温度至T1的同时缩小体积至体系压强增大,达到新的平衡状态时,可能是图中A~F点中的___________点(填标号)。
(3)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(4)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
(5)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
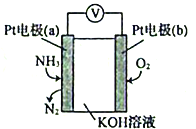
①电极b上发生的是___________反应(填“氧化”或“还原”)。
②电极a的电极反应为_______________________。