题目内容
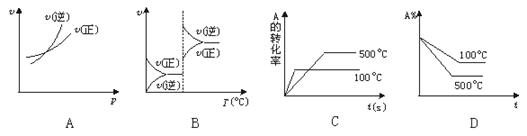
在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),有关下列图像的说法正确的是
2Z(g),有关下列图像的说法正确的是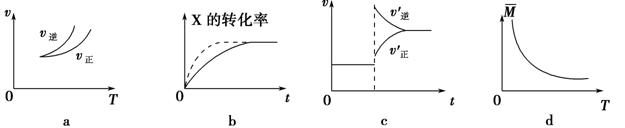
| A.依据图a可判断正反应为吸热反应 |
| B.在图b中,虚线可表示压强增大 |
| C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0 |
C
解析试题分析:A.依据图a可知:当反应达到平衡后,由于升高温度,V逆>V正,平衡逆向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,因此可判断正反应为放热反应,错误;B.在图b中,平衡未移动,但是达到平衡所需要的时间缩短,由于该反应是气体体积减小的反应,所以虚线不可表示压强增大,只能表示是加入了催化剂,错误;C.若正反应的ΔH<0,升高温度,根据平衡移动原理,平衡逆向移动,故可以用图c可表示升高温度使平衡向逆反应方向移动,正确;D.由于升高温度,气体的平均相对分子质量增大,则根据平衡移动原理,升高温度,平衡向吸热反应方向移动,平衡逆向移动,可推知正反应的ΔH<0,错误。
考点:考查外界条件对化学平衡移动的影响的知识。

在恒容密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) 
 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.温度不变同时充入Ar | D.降低温度同时增大压强 |
决定化学反应速率的主要因素是
| A.催化剂 | B.参加反应的物质本身的性质 |
| C.反应物的浓度 | D.温度、压强以及反应物的接触面 |
在反应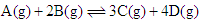 中,表示该反应速率最快的是( )
中,表示该反应速率最快的是( )
A. | B.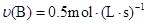 |
C.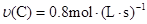 | D.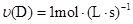 |
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
| A.c1∶c2="=" 1∶3 | B.平衡时,Y和Z生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1< 0.14 mol?L-1 |
现有可逆反应:X(g)+Y(g) 2Z(g)+W(s)
2Z(g)+W(s)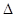 H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是
H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是
| A.降低温度 | B.增大Y的浓度 | C.加入催化剂 | D.增大容器的体积 |
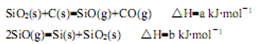
 Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
 2C(g)(正反应吸热),下列图象中正确的是
2C(g)(正反应吸热),下列图象中正确的是