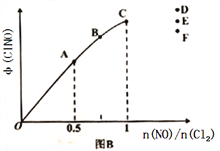
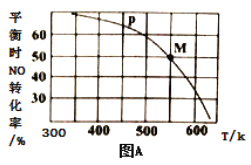
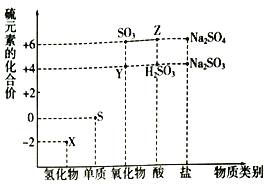
题目内容
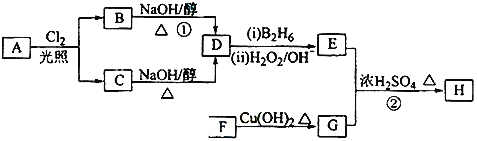
【题目】某课外活动小组利用下列化学反应在实验室中制备氯气,并进行有关氯气性质的研究。MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该小组同学欲用下图所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。


①应该选择的仪器是________(填字母)。
②浓盐酸与二氧化锰反应的离子方程式为____________________________
(2)该小组同学设计并分别利用下图所示装置探究氯气的氧化性。

①G中的现象是________,原因是__________________(用化学方程式表示)。
②H中的现象是__________________。
【答案】ACDBE MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 溶液由无色变为蓝色 Cl2+2KI=I2+2KCl 产生白色沉淀
Mn2++Cl2↑+2H2O 溶液由无色变为蓝色 Cl2+2KI=I2+2KCl 产生白色沉淀
【解析】
MnO2与浓盐酸在加热条件下反应制取氯气,制取的氯气中含有杂质HCl、水蒸气,先通过饱和食盐水除去杂质HCl,然后通过浓硫酸干燥氯气,然后利用氯气的密度比空气大,用向上排空气的方法收集,就得到干燥纯净的氯气,氯气是大气污染物,根据氯气能够与强碱溶液反应的性质用NaOH溶液吸收多余的氯气,进行尾气处理。利用活动性强的可以将活动性弱的从相应的盐中置换出来,然后根据I2遇淀粉溶液变为蓝色,验证氯气的强氧化性,可以根据氯气具有氧化性,也可以通过在溶液中将SO2氧化为硫酸,根据硫酸与可溶性钡盐反应产生难溶性的BaSO4白色沉淀来检验氯气的强氧化性。
(1) ①利用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,在A中制取Cl2,由于浓盐酸具有挥发性,制取得到的氯气中含有杂质HCl、水蒸气,先通过C装置用饱和食盐水除去杂质HCl气体,然后再通过D装置用浓硫酸来干燥氯气,根据氯气的密度比空气大,用B装置采用向上排空气的方法收集氯气,由于氯气是有毒的气体,会造成大气污染,所以在排放前要进行尾气处理,根据Cl2+2NaOH=NaCl+NaClO+H2O,通过E装置进行尾气处理,因此使用装置的先后顺序为A、C、D、B、E;
MnCl2+Cl2↑+2H2O,在A中制取Cl2,由于浓盐酸具有挥发性,制取得到的氯气中含有杂质HCl、水蒸气,先通过C装置用饱和食盐水除去杂质HCl气体,然后再通过D装置用浓硫酸来干燥氯气,根据氯气的密度比空气大,用B装置采用向上排空气的方法收集氯气,由于氯气是有毒的气体,会造成大气污染,所以在排放前要进行尾气处理,根据Cl2+2NaOH=NaCl+NaClO+H2O,通过E装置进行尾气处理,因此使用装置的先后顺序为A、C、D、B、E;
②制取氯气的反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O改写为离子形式,根据物质的存在状态及离子方程式拆分原则,可得相应的离子方程式为MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O改写为离子形式,根据物质的存在状态及离子方程式拆分原则,可得相应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)①将氯气通入到含有淀粉KI溶液的G试管中,由于氧化性Cl2>I2,所以会发生反应:Cl2+2KI=I2+2KCl,反应产生的I2遇淀粉溶液变为蓝色,所以看到的现象是溶液由无色变为蓝色;
②将氯气通入到溶有SO2气体的BaCl2溶液的H中,发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,反应产生的硫酸会进一步发生反应:BaCl2+H2SO4=BaSO4↓+2HCl,因此会看到H中的现象是产生白色沉淀。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L—1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500s内O2的平均生成速率为7.4×l0—4mol·L—1·s—1
B. T1温度下该反应达到平衡时,平衡混合物中NO2的体积分数为50%
C. 达到平衡后,其他条件不变,将容器体积压缩到原来的1/2,则c(N2O5)>5.00mol·L—1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2