题目内容
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂。可通过反应获得:2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=______________(用K1和K2表示)。
(2)按投料比[n(NO):n(Cl2)=2:1]把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强P(总压)的关系如图A所示:
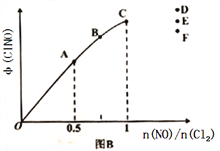
①该反应的△H______0(填“>”“<”或“=”);
②在P压强条件下,M点时容器内NO的体积分数为_________;
③若反应一直保持在P压强条件下进行,则M点的分压平衡常数Kp=__________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
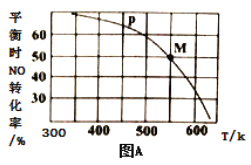
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数的变化图像如图B,则A、B、C三状态中,NO的转化率最大的是_________点;当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____________点。
【答案】 K12/K2 < 40% Kp=5/P A D
【解析】(1)根据盖斯定律:将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K。
(2)①由图象可知,温度升高,NO转化率减小,平衡左移,该反应正反应为放热反应。②按投料比[n(NO):n(Cl2)=2:1]把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率50%,结合三行计算列式计算得到。
(3)根据三段式结合一氧化氮的转化率,计算出平衡浓度, 计算该反应的平衡常数K。
(4)n(NO)/n(Cl2)的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大,NO的转化率最大的是A点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)= 1.5时,产物的含量增大。
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g);②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g);根据盖斯定律:将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),则平衡常数K3= K12/K2;正确答案K12/K2。
(2)①由图象可知,温度升高,NO转化率减小,平衡左移,该反应正反应为放热反应,△H<0;正确答案:<。
②按投料比[n(NO):n(Cl2)=2:1]把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率50%,进行如下计算:
2NO(g)+Cl2(g)2ClNO(g)
起始量(mol ) 2 1 0
变化量(mol) 2×50% 0.5 1
平衡量(mol) 1 0.5 1
容器内NO的体积分数=1/(1+0.5+1)×100%=40%;正确答案40%。
③ 2NO(g)+Cl2(g)2ClNO(g)
起始量(mol ) 2 1 0
变化量(mol) 2×50% 0.5 1
平衡量(mol) 1 0.5 1
平衡总物质的量=2.5mol,一氧化氮的分压为0.4p,Cl2的分压为0.2p,ClNO分压为0.4 p;该反应的平衡常数Kp=(0.4p)2/(0.4p)2×0.2p=5/P;正确答案:5/P。
(3)n(NO)/n(Cl2)的比值越小,说明若n(NO)不变,n(C12)越大,所以NO的转化率越大,NO的转化率最大的是A点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)= 1.5时,产物的含量增大,所以应该是D点;正确答案:A ;D。






