题目内容
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
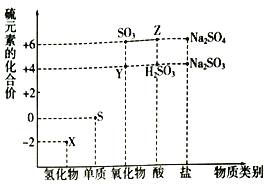
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有______________(填化学式)((填一种就可以)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3) Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为____________。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol/L的Na2SO3溶液与 20 mL 0.02 mol/L的溶液恰好反应时,Cr元素在还原产物中的化合价为____________。
【答案】SO2、H2SO3、Na2SO3 (填一种) 1∶2 Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑ b +3
CuSO4+2H2O+SO2↑ b +3
【解析】
S元素的化合价有-2价、0价、+4价、+6价,
(1)具有中间价态的元素既有还原性又有氧化性;
(2)将X为H2S与SO2混合,可生成淡黄色固体,是用SO2的氧化性氧化H2S生成淡黄色沉淀S和水,元素化合价降低的物质作氧化剂,元素化合价降低的作还原剂分析判断;
(3)浓硫酸与铜单质在加热时发生反应生成硫酸铜、二氧化硫和水;
(4)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
(5)Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;K2Cr2O7中Cr元素发生还原反应,假设Cr元素在产物中的化合价为a价,根据电子转移守恒计算a的值。
S元素的化合价有-2价、0价、+4价、+6价。
(1)具有中间价态的元素既有还原性又有氧化性,S元素的化合价有-2价、0价、+4价、+6价,所以0价和+4价S的化合物既有还原性又有氧化性,图中既有氧化性又有还原性的化合物有SO2,H2SO3、Na2SO3;
(2)将X为H2S与SO2混合,可生成淡黄色固体,是用SO2的氧化性氧化H2S生成淡黄色沉淀S和水,反应方程式为2H2S+SO2=3S↓+2H2O,反应中硫元素化合价-2价变化为0价,H2S作还原剂,+4价变化为0价,二氧化硫作氧化剂,则该反应的氧化剂与还原剂的物质的量之比为1:2;
(3)浓硫酸与铜单质在加热条件下可以发生化学反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c、d中S的化合价都大于2,均布符合题意,只有b中Na2SO3的S为+4价,单质S为0价,一种大于2,一种小于2,故选项 b符合题意;
(5)假设Cr元素在产物中的化合价为+a价,根据电子转移守恒,则24×10-3L×0.05mol/L×(6-4)=20×10-3L×0.02mol/L×2×(6-a),解得a=+3。