题目内容
【题目】将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+![]() Cr3++Fe3++H2O ②,下列有关说法正确的是
Cr3++Fe3++H2O ②,下列有关说法正确的是
A. 还原性:Cr3+>SO2 B. 配平后方程式②中,a=6,b=7
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 方程式①中W为OH-
【答案】C
【解析】
由反应①②中各元素的价态变化可知,反应①中,SO2为还原剂,Fe3+为氧化剂,且还原性为SO2>Fe2+,氧化性为Fe3+>SO42-。反应②中,Fe2+为还原剂,Cr2O72-为氧化剂,且还原性为Fe2+>Cr3+,氧化性为Cr2O72->Fe3+。由此可见选项A错误。选项B,配平反应②:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故a=6,b=14,错误。选项C,由于Cr2O72-具有氧化性,Na2SO3具有还原性,故Cr2O72-能将Na2SO3氧化成Na2SO4,正确。选项D,根据质量守恒定律,可知反应①中W为H+,错误。

【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25[ | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
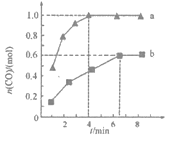
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是______(填“A”或“B”);比较р1、р2的大小关系_______。

(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )