题目内容
欲配制100 ml 1.0 mol/L Na2SO4溶液,正确的方法是
①将14.2 g Na2SO4 溶于100 ml水中
②将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
B
解析试题分析:①物质的量浓度是在一定体积的溶液中含溶质的物质的量来表示溶液组成的物理量。溶剂的体积不等于溶液的体积。错误。②C="n/V=(m÷M)/V=(32.2g÷322g/mol)/0.1L=1.0" mol/L。③可利用溶液的稀释公式C1V1=C2V2. 假设稀释后溶液的浓度为X.则:20 ml× 5.0 mol/L="100" ml×X,解得X ="1.0" mol/L。所以符合要求的方法是②③。正确选项为B。
考点:考查溶液的稀释公式及一定物质的量浓度的溶液的配制方法等的知识。

在标准状况下有:①6.72 L CH4;②3.01×1023个氯化氢分子;③13.6 g硫化氢;④0.2 mol氨气。四种气体中含有的氢原子数大小顺序为
| A.①>③>④>② | B.②>③>④>① |
| C.①>④>②>③ | D.②>③>①>④ |
体积均为aL的硫酸钾、硫酸锌、硫酸铁溶液,均能和bL1mol/LBaCl2溶液恰好完全反应。则硫酸钾、硫酸锌、硫酸铁的物质的量浓度之比约为( )
| A.3:2:2 | B.3:3:1 | C.1:3:3 | D.1:2:3 |
某实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)= c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是
c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是
| A.KCl、Na2SO4 | B.KCl、Na2SO4、NaCl |
| C.NaCl、Na2SO4、K2SO4 | D.KCl、K2SO4、Na2SO4 |
下列说法正确的是
| A.标准状况下,22.4LCO2与22.4LH2SO4含有相同的分子数。 |
| B.标准状况下,1mol氧气和氮气的混和气体(任意比)的体积约为22.4L |
| C.常温下32gO2含分子数小于NA个。 |
| D.22.4L气体所含的分子数一定大于11.2L气体所含的分子数。 |
下列变化一定属于化学变化的是
①风化 ②变色 ③燃烧 ④爆炸 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色 ⑧分馏 ⑨NO2气体冷却后颜色变浅 ⑩潮解
| A.①②③④⑦ | B.③④⑤⑦ | C.①③④⑦⑩ | D.①③⑤⑦⑨ |
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X。则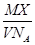 表示的是
表示的是
| A.VL该气体的质量(以g为单位) |
| B.1L该气体的质量(以g为单位) |
| C.1mol该气体的体积(以L为单位) |
| D.1L该气体中所含的分子数 |
下列表述正确的是
| A.一氯甲烷的结构式CH3Cl |
| B.乙醇的分子式CH3CH2OH |
C.乙烷的球棍模型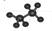 |
D.Cl-结构示意图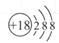 |
下列叙述不正确的是
| A.与28 gCO具有相同分子数的C2H4的质量一定是28 g |
| B.1 molAl3+含有的核外电子数为3NA |
| C.常温常压下,1 molL甲烷含有的原子数为5NA |
| D.1 L 1 mol·L-1醋酸溶液中CH3COO+的数目小于NA |