题目内容
某实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)= c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是
c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是
| A.KCl、Na2SO4 | B.KCl、Na2SO4、NaCl |
| C.NaCl、Na2SO4、K2SO4 | D.KCl、K2SO4、Na2SO4 |
AC
解析试题分析:A、若KCl、Na2SO4的物质的量相同时,则电离生成的离子关系为 c(K+)=c(Cl-)= c(Na+)=c(SO42-),故A正确;B、若c(K+)=c(Cl-),则该溶液中溶质不可能有氯化钠,故B错误;C、若c(K+)=c(Cl-),则硫酸钾的物质的量是氯化钠的2倍。则只要在满足硫酸钠的物质的量等于硫酸钾即可满足c(K+)=c(Cl-)=
c(Na+)=c(SO42-),故A正确;B、若c(K+)=c(Cl-),则该溶液中溶质不可能有氯化钠,故B错误;C、若c(K+)=c(Cl-),则硫酸钾的物质的量是氯化钠的2倍。则只要在满足硫酸钠的物质的量等于硫酸钾即可满足c(K+)=c(Cl-)= c(Na+)=c(SO42-)成立,故C正确;D、KCl、K2SO4、无论以何种比例混合,都c(K+)>c(Cl-),因此不会满足C c(K+)=c(Cl-)=
c(Na+)=c(SO42-)成立,故C正确;D、KCl、K2SO4、无论以何种比例混合,都c(K+)>c(Cl-),因此不会满足C c(K+)=c(Cl-)= c(Na+)=c(SO42-),故D错误,答案选AC。
c(Na+)=c(SO42-),故D错误,答案选AC。
考点:考查电解质在溶液中电离出离子浓度大小关系的有关计算

下列叙述中正确的是
①标准状况下,1 L HCl和1 L H2O的物质的量相同;
②标准状况下,1 g H2和14 g N2的体积相同;
③28 g CO的体积为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤在同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
| A.①②③ | B.②⑤⑥ | C.②③⑥ | D.②④⑤ |
下列化学用语使用正确的是
| A.石英的化学式:CaCO3 | B.CO2的电子式: |
| C.HClO的结构式:H-O-Cl | D.Mg2+的结构示意图: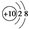 |
下列说法正确的是
| A.摩尔质量就等于物质的量 | B.摩尔质量就是物质的量的6.02×1023倍 |
| C.HNO3的摩尔质量是63 g | D.硫酸和磷酸的摩尔质量相等 |
下列叙述正确的是( )
| A.同温同压下,相同体积的物质,其物质的量一定相等 |
| B.任何条件下,等体积的甲烷和一氧化碳所含的分子数一定相等 |
| C.1L一氧化碳气体一定比1L氧气的质量小 |
| D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2LH2O含有的分子数为0.5NA |
| B.含有NA个氦原子的氦气在标准状况下的体积约为l1. 2L |
| C.25℃,l标准大气压下,64gSO2中含有的原子数为3NA |
| D.在常温常压下,11. 2LCl2含有的分子数为0.5NA |
欲配制100 ml 1.0 mol/L Na2SO4溶液,正确的方法是
①将14.2 g Na2SO4 溶于100 ml水中
②将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
| A.原混合酸中NO3-物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
0.8g某物质含有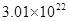 个分子,该物质的相对分子质量约为
个分子,该物质的相对分子质量约为
| A.8 | B.16 | C.64 | D.160 |