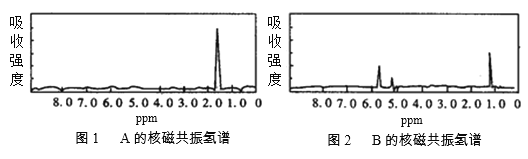
题目内容
【题目】已知 1g 氢气完全燃烧生成液态水时放出热量 143kJ,18g 水蒸气变成液态水放出 44kJ 的热量。其他相关数据如下表:则表中 x 为( )
O=O | H-H | H-O(g) | |
1mol 化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
A.920B.557C.463D.188
【答案】C
【解析】
试题1g氢气完全燃烧生成液态水时放出热量143kJ,故2mol氢气燃烧生成2mol液态水时放出热量为![]() ×143kJ=572kJ,18g水蒸气变成液态水放出44kJ的热量,2mol液态水变为气态水吸收的热量为
×143kJ=572kJ,18g水蒸气变成液态水放出44kJ的热量,2mol液态水变为气态水吸收的热量为![]() ×44kJ=88kJ,故2mol氢气燃烧生成2mol气态水时放出热量为572kJ-88kJ=484kJ,故热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,所以2×436kJ/mol+496kJ/mol-4xkJ/mol= -484kJ/mol,解得x=463,故选C。
×44kJ=88kJ,故2mol氢气燃烧生成2mol气态水时放出热量为572kJ-88kJ=484kJ,故热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,所以2×436kJ/mol+496kJ/mol-4xkJ/mol= -484kJ/mol,解得x=463,故选C。

练习册系列答案
相关题目