题目内容
【题目】一定量的CuS和![]() 的混合物投入足量的
的混合物投入足量的![]() 中,收集到气体
中,收集到气体![]() 标准状况
标准状况![]() ,向反应后的溶液中
,向反应后的溶液中![]() 存在
存在![]() 和
和![]() 加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到
加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到![]() ,若上述气体为NO和
,若上述气体为NO和![]() 的混合物,且体积比为
的混合物,且体积比为![]() ,则V可能为
,则V可能为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】B
【解析】
若混合物全是CuS,其物质的量![]() ,硫元素化合价变化从-2到+6价,转移电子物质的量
,硫元素化合价变化从-2到+6价,转移电子物质的量![]() ,NO和
,NO和![]() 的体积相等,
的体积相等,
设NO的物质的量为x、![]() 的物质的量为x,则
的物质的量为x,则![]() ,解得:
,解得:![]() ,故气体体积
,故气体体积![]() ;
;
若混合物全是![]() ,其物质的量
,其物质的量![]() ,硫元素化合价变化从-2到+6价,铜元素化合价从+1到+2,铜原子个数为2,转移电子物质的量
,硫元素化合价变化从-2到+6价,铜元素化合价从+1到+2,铜原子个数为2,转移电子物质的量![]() ,设NO为xmol、
,设NO为xmol、![]() 为xmol,
为xmol,![]() ,计算得
,计算得![]() ,气体体积为:
,气体体积为:![]() ,
,
由于是CuS和![]() 的混合物,则生成的气体体积介于
的混合物,则生成的气体体积介于![]() 之间,所以B正确,
之间,所以B正确,
答案选B。

【题目】纳米磷酸钙是理想的生物材料,可用作骨骼和牙用骨水泥。将含有脲酶的Na3PO4溶液加入处于高速搅状态的尿素[CO(NH2)2]、CaC12和盐酸混合液中,可制得纳米磷酸钙。
已知:①CO(NH2)2+H2O![]() 2NH3+CO2
2NH3+CO2
②25℃时,H3PO4的Ka1=7.5×10-3 、Ka2=6.3×10-8、Ka3=4.4×10-13;Ca3(PO4)2的Ksp=3.3×10-9。
(1)实验过程若降低搅拌速率,可能造成的不良后果是___________。
(2)尿素水解液呈碱性,则c(![]() )___________ c(
)___________ c(![]() )(填“>”或“<”)
)(填“>”或“<”)
(3)混合后,溶质的初始浓度如下表
物质 | CaCl2 | HCl | NaH2PO4 | NaCl | 尿素 | 脲酶 |
初始浓度 mol/L | 0.25 | 5×10-3 | 0.05 | 1 | 1.0 | 20U/mL |
①生成![]() 的离子方程式为___________。
的离子方程式为___________。
②初始时刻,溶液中含磷微粒浓度从大到小的顺序为___________。
③判断此时能否生成Ca3(PO4)2沉淀___________ (列式计算) 。
(4)上述实验条件下,溶液的浊度、pH与反应时间t的关系如图所示,实验表明,pH在7.8-8.1之间出现周期性振荡,相关分析不正确的是___________ (填序号) 。
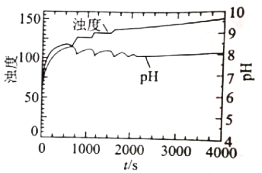
A.振荡周期内,PO43-浓度不变
B.随着尿素水解反应的进行,pH升高
C.随着磷酸钙沉淀的生成,pH下降
D.尿素水解速率和磷酸钙沉淀速率的差异引起pH周期性振荡
【题目】已知 1g 氢气完全燃烧生成液态水时放出热量 143kJ,18g 水蒸气变成液态水放出 44kJ 的热量。其他相关数据如下表:则表中 x 为( )
O=O | H-H | H-O(g) | |
1mol 化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
A.920B.557C.463D.188
【题目】![]() 俗称海波
俗称海波![]() 是常用的一种定影剂。工业使用的海波中常混有少量
是常用的一种定影剂。工业使用的海波中常混有少量![]() 和
和![]() 的杂质,为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀硫酸20mL,充分反应后测得有关实验数据如下
的杂质,为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀硫酸20mL,充分反应后测得有关实验数据如下![]() 标准状况
标准状况![]() 。
。
第一份 | 第二份 | 第三份 | |
样品的质量 |
|
|
|
二氧化硫的体积 |
|
|
|
硫的质量 |
|
|
|
下列说法错误的是 ![]()
![]()
A.第一份、第二份样品均完全反应,第三份样品过量
B.样品中![]() :
:![]() :1
:1
C.样品中除了含有![]() 、
、![]() ,还含有
,还含有![]()
D.所加硫酸溶液的物质的量浓度为![]()
【题目】室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②