题目内容
工业上用甲醇在酸性介质中与氯酸钠反应制备二氧化氯(ClO2)的反应为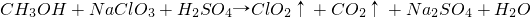 (方程式未配平).下列有关说法不正确的是
(方程式未配平).下列有关说法不正确的是
- A.NaClO3中氯元素得电子,化合价降低被还原
- B.该反应中反应物的总能量一定大于生成物的总能量
- C.NaClO3和Na2SO4都属于离子化合物,且都含有共价键
- D.反应过程中,每转移4mol电子生成22.4L CO2(标准状况)
BD
分析:A.在氧化还原反应中,得电子化合价降低元素被还原,化合价升高的元素被氧化;
B.根据反应物和生成物能量的相对大小判断;
C.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
D.根据转移电子和二氧化碳之间的关系式计算.
解答:A.该反应中,氯元素的化合价由+5价变为+4价,所以氯元素得电子化合价降低被还原,故A正确;
B.因为反应物和生成物能量的相对大小未知,无法判断该反应是放热反应还是吸热反应,故B错误;
C.氯酸钠和硫酸钠都是离子化合物,氯酸钠中氧元素和氯元素之间存在共价键,硫酸钠中硫元素和氧元素之间存在共价键,故C正确;
D.反应过程中,每转移4mol电子生成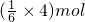 ×22.4L/mol=14.9L CO2(标准状况),故D错误;
×22.4L/mol=14.9L CO2(标准状况),故D错误;
故选BD.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,知道甲醇中碳元素的化合价,为易错点.
分析:A.在氧化还原反应中,得电子化合价降低元素被还原,化合价升高的元素被氧化;
B.根据反应物和生成物能量的相对大小判断;
C.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
D.根据转移电子和二氧化碳之间的关系式计算.
解答:A.该反应中,氯元素的化合价由+5价变为+4价,所以氯元素得电子化合价降低被还原,故A正确;
B.因为反应物和生成物能量的相对大小未知,无法判断该反应是放热反应还是吸热反应,故B错误;
C.氯酸钠和硫酸钠都是离子化合物,氯酸钠中氧元素和氯元素之间存在共价键,硫酸钠中硫元素和氧元素之间存在共价键,故C正确;
D.反应过程中,每转移4mol电子生成
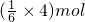 ×22.4L/mol=14.9L CO2(标准状况),故D错误;
×22.4L/mol=14.9L CO2(标准状况),故D错误;故选BD.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,知道甲醇中碳元素的化合价,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
工业上用甲醇在酸性介质中与氯酸钠反应制备二氧化氯(C1O2)的反应为CH3OH+NaC1O3+H2SO4→C1O2↑+CO2↑+Na2SO4+H2O _ (方程式未配平).下列有关说法不正确的是( )
| A、NaC1O3中氯元素得电子,化合价降低被还原 | B、该反应中反应物的总能量一定大于生成物的总能量 | C、NaC1O3和Na2SO4都属于离子化合物,且都含有共价键 | D、反应过程中,每转移4mol电子生成22.4L CO2(标准状况) |
工业上制备二氧化氯(ClO2)的方法之一是用甲醇在酸性介质中与氯酸钠反应,其反应方程式为:
CH3OH+NaClO3+H2SO4→C1O2↑+CO2↑+Na2SO4+H2O(未配平),则下列说法正确的是( )
CH3OH+NaClO3+H2SO4→C1O2↑+CO2↑+Na2SO4+H2O(未配平),则下列说法正确的是( )
| A、甲醇是氧化剂 | B、通过反应可判断NaClO3的氧化性强于Na2SO4 | C、还原产物和氧化产物的物质的量之比为6:l | D、生成1molCO2时转移电子的物质的量为4mol |