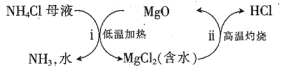
题目内容
【题目】(1)1.204×1024个H2SO4分子共含_______个氢原子。将上述H2SO4溶于水配成600 mL溶液,再加水稀释到1000 mL,稀释后溶液的物质的量浓度为_______mol/L。
(2)22 gNa2R2中含0.4 mol的Na+,则R的相对原子质量是_____________。
(3)把100mL0.3mol/LNa2SO4溶液和400mL0.2mol/LNaCl溶液混合后,溶液中Na+的物质的量浓度为_____________(假设混合时溶液体积变化忽略不计)
(4)K2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的浓度为0.5 mol/L,SO42-浓度为0.9 mol/L,则K+的物质的量浓度为_______________mol/L。
(5)把标准状况下V L气体(摩尔质量M g/mol)溶于1 L水中(不考虑反应),所得溶液密度为ρg/cm3,则此溶液的物质的量浓度为__________________。
【答案】4NA 2 32 0.28 mol/L 0.3 ![]() mol/L
mol/L
【解析】
本题主要考查物质的量计算。(1)(2)(3)依据![]() 结合物质的成分的构成进行计算;
结合物质的成分的构成进行计算;
(4)根据溶液中电荷守恒计算K+浓度;
(5) 依据![]() 和
和![]() 计算溶液的物质的量浓度。
计算溶液的物质的量浓度。
(1)1个硫酸分子含有2个氢原子,则![]() 个H2SO4分子含有氢原子个数为:
个H2SO4分子含有氢原子个数为:![]() ,即共含4NA个氢原子,将该H2SO4溶于水配成600mL溶液,稀释至1000mL,得到硫酸的物质的量浓度为:
,即共含4NA个氢原子,将该H2SO4溶于水配成600mL溶液,稀释至1000mL,得到硫酸的物质的量浓度为:![]() 。
。
故答案为:4NA; 2。
(2)22gNa2R2中含0.4mol的Na+,则Na2R2的物质的量为:![]() ,
,![]() ,Na2R2的相对原子质量为110
,Na2R2的相对原子质量为110![]() ,则R的相对原子质量=(110-23×2)×1/2=32,
,则R的相对原子质量=(110-23×2)×1/2=32,
故答案为:32。
(3) 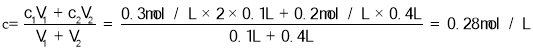 ,故答案为:0.28 mol/L;
,故答案为:0.28 mol/L;
(4)Fe3+的浓度为0.5 mol/L,SO42-浓度为0.9 mol/L,则K+的物质的量浓度c=2c(SO42-)-3C(Fe3+)= 0.3 mol/L,故答案为:0.3;
(5)溶质物质的量![]() ,溶液体积
,溶液体积![]() ,溶液物质的量浓度为
,溶液物质的量浓度为![]() ;故答案为:
;故答案为:![]() mol/L。
mol/L。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案