题目内容
【题目】室温下,向100 mL 0.1 mol/L NH4Cl溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A. | 100 mL 0.1 mol/L盐酸 | 溶液中2c(NH4+)=" " c(Cl-) |
B. | 0.01 mol Na2O2固体 | 反应完全后,溶液pH增大,c(Na+) = 2c(Cl-) |
C. | 100 mL H2O | 由水电离出的c(H+)c(OH-)不变 |
D. | 100 mL 0.1 mol/L NH3H2O | 溶液中 |
A. A B. B C. C D. D
【答案】B
【解析】试题分析:A.向100 mL 0.1 mol/L NH4Cl溶液中加入100 mL 0.1 mol/L盐酸,溶液中存在物料守恒,2c(NH4+) +2 c(NH3·H2O)= c(Cl-),故A错误;B.向100 mL 0.1 mol/L NH4Cl溶液中加入0.01 mol Na2O2固体,过氧化钠与水反应生成0.02mol氢氧化钠,与氯化铵反应生成氨水和氯化钠,剩余0.01molNaOH,溶液显碱性,pH增大,c(Na+) = 2c(Cl-) ,故B正确;C.向100 mL 0.1 mol/L NH4Cl溶液中加入100 mL H2O,促进氯化铵的水解,水的电离受到抑制,由水电离出的c(H+)c(OH-)减小,故C错误;D.向100 mL 0.1 mol/L NH4Cl溶液中加入100 mL 0.1 mol/L NH3H2O,溶液的碱性增强, 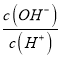 增大,故D错误;故选B。
增大,故D错误;故选B。

 名校课堂系列答案
名校课堂系列答案【题目】已知酸性条件下有反应:2Cu+=Cu2++Cu。氢气还原氧化铜实验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。某同学对某次氢气还原氧化铜的红色固体产物做了如下实验,实验操作和实验现象列表如下:
加入 试剂 | 稀硫酸 | 浓硫酸 并加热 | 稀硝酸 | 浓硝酸 |
实验 现象 | 红色固体 不反应 | 无色气体 | 无色气体 蓝色溶液 | 红棕色气体 蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物( )
A. 是Cu B. 是Cu2O C. 一定有Cu,一定有Cu2O D. 一定有Cu2O,可能有Cu