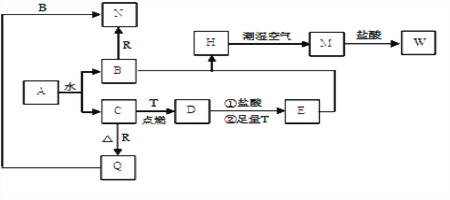
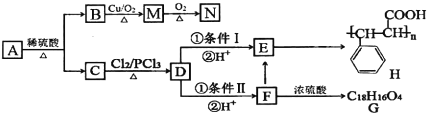
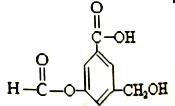
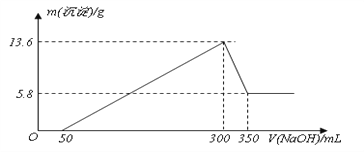
题目内容
【题目】工业废水中常含有一定量的 Cr2O72-和 CrO42-,它们会对生态系统产生很大的伤害,工业上对废水处理的工艺流程如下
![]()
(1)CrO4中 Cr 的化合价 ;Cr3+的核外电子排布式为 。
(2)写出第①步发生的离子反应方程式 ;若常温下,减小平衡体系的 pH 至 pH=2,则溶液趋向于显 色。
(3)第②步中,还原 0.01mol Cr2O72-离子,需要 mol 的 FeSO4·7H2O
(4)已知 Cr(OH)3 在溶液中存在以下平衡:H++CrO2-+H2O ![]() Cr(OH)3
Cr(OH)3![]() Cr3++3OH-下列有关说法中正确的是
Cr3++3OH-下列有关说法中正确的是
a.加 HCl 则平衡均向右移动,则生成 Cr3+盐
b.按照物质分类 Cr(OH)3 是两性氢氧化物,属于弱电解质
c.Cr3+盐中逐滴加入 NaOH 溶液,先产生沉淀,后沉淀消失
d.Cr(OH)3 饱和溶液中一定有 c(H )=c(OH )
【答案】(1)+6,1s22s22p63s23p63d4;
(2)2CrO42-(黄色)+2H+![]() Cr2O72-+2H2O,橙色;
Cr2O72-+2H2O,橙色;
(3)0.06mol;(4)abc。
【解析】
试题分析:(1)氧显-2价,整体显-2价,因此Cr的化合价为+6价,Cr位于第四周期VIB族元素,Cr3+的排布式为:1s22s22p63s23p63d4;(2)根据①,离子反应方程式为:2CrO42-(黄色)+2H+![]() Cr2O72-+2H2O,Cr2O72-显橙色,减小pH,增大c(H+)平衡向正反应方向移动,Cr2O72-浓度增大,即溶液显橙色;(3)根据得失电子数目守恒,有n(FeSO4·7H2O)×1=0.01×2×3,解得n(FeSO4·7H2O)=0.06mol;(4)a、加入HCl,c(H+)增大,平衡向正反应方向进行,生成Cr3+,故正确;b、根据电离方程式,既有酸式电离,又有碱式电离,说明Cr(OH)3表现两性,故正确;c、根据电离平衡,加入OH-先产生Cr(OH)3,后沉淀消失,故正确;d、溶液显碱性,c(H+)<c(OH-),故错误。
Cr2O72-+2H2O,Cr2O72-显橙色,减小pH,增大c(H+)平衡向正反应方向移动,Cr2O72-浓度增大,即溶液显橙色;(3)根据得失电子数目守恒,有n(FeSO4·7H2O)×1=0.01×2×3,解得n(FeSO4·7H2O)=0.06mol;(4)a、加入HCl,c(H+)增大,平衡向正反应方向进行,生成Cr3+,故正确;b、根据电离方程式,既有酸式电离,又有碱式电离,说明Cr(OH)3表现两性,故正确;c、根据电离平衡,加入OH-先产生Cr(OH)3,后沉淀消失,故正确;d、溶液显碱性,c(H+)<c(OH-),故错误。

【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
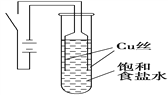
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
※ 相同温度下CuCl的溶解度大于CuOH。
下列说法错误的是( )
A. 反应结束后最终溶液呈碱性 B. 阴极上发生的电极反应为:2H2O + 2e- == H2↑+ 2OH-
C. 电解过程中氯离子移向阳极 D. 试管底部红色的固体具有还原性