题目内容
【题目】将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,再逐滴加入2mol L-1的NaOH溶液至过量,所生成的沉淀与所加NaOH的关系如图所示。
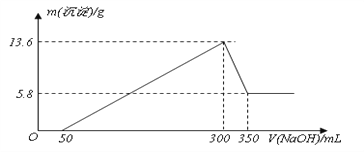
(1)0~50mL段内,发生反应的离子方程式为_________________。
(2)300~350mL段内,发生反应的离子方程式为________________。
(3)试计算该盐酸的浓度___。(写出必要的计算过程)
【答案】 H++OH—=H2O Al(OH)3+OH—=AlO2—+2H2O 当V(NaOH)=300mL 时,溶液中溶质仅为NaCl,依据电荷守恒:
n(HCl)= n(NaOH)=0.3L×2mol L-1=0.6mol
c(HCl)= 0.6mol÷0.2L=3mol L-1(2分)
【解析】试题分析:将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,溶质为氯化铝、氯化镁及可能剩余的盐酸,再逐滴加入2mol L-1的NaOH溶液至过量,依次发生的反应是H++OH—=H2O、![]() 、
、![]() 、Al(OH)3+OH—=AlO2—+2H2O;
、Al(OH)3+OH—=AlO2—+2H2O;
解析:根据以上分析,(1)0~50mL段内没有生成沉淀,所以0~50mL段内是盐酸与氢氧化钠反应,离子方程式为H++OH—=H2O。
(2)300~350mL段内沉淀量减小,应该是氢氧化铝溶于了氢氧化钠中,发生反应的离子方程式为Al(OH)3+OH—=AlO2—+2H2O。
(3) 用元素守恒法 沉淀最多时,溶液中只有氯化钠(镁,铝全部形成沉淀) 氯化钠中氯来自盐酸,钠来自氢氧化钠,且两者的物质的量之比为1:1,n(HCl)=n(NaOH)=0.3L×2mol L-1=0.6mol
c(HCl)= 0.6mol÷0.2L=3mol L-1。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
