题目内容
【题目】在催化剂的作用下会发生反应:CO(g)+2H2(g)CH3OH(g)。回答下列问题:
(1)某温度下,将2molCO与5molH2的混合气体充入容积为2L 的恒容密闭容器中,经过5 min 后,反应达到平衡,此时转移 6 mol电子。从起始至平衡时v(CH3OH)=______mol·L-1·min-1,该反应的平衡常数为______L2·mol-2。
(2)在一定压强下,向容积为V L的容器中充入a molCO与2a molH2,在催化剂作用下反应生成甲醇,CO 平衡转化率与温度、压强的关系如图所示。
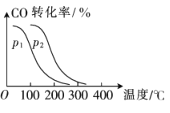
①p1____(填“>” “<”或“=”,下同)p2,△H_____0。
②下列能使该反应的化学反应速率增大,且平衡向正反应方向移动的是 __________(填字母)。
A.及时分离出CH3OH气体 B.适当升高温度
C.增大H2的浓度 D.选择高效催化剂
【答案】0.15 3 < < C
【解析】
根据电子转移的物质的量计算反应的CO的物质的量,进而计算化学反应速率,结合三段式计算化学平衡常数,由“定一议二”比较压强大小,通过温度对平衡的影响判断反应吸放热情况,根绝化学反应速率和平衡移动的影响因素进行判断。
(1)根据题干信息可知,反应CO(g)+2H2(g)CH3OH(g)中,每消耗1molCO,转移4mol电子,因此在反应达到平衡时转移6mol电子,说明从起始至平衡CO消耗了1.5mol,列三段式有:

所以 ,平衡常数
,平衡常数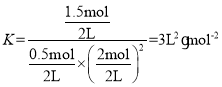 ;
;
(2)①根据图像分析,温度相同时,p1到p2的过程CO的转化率增大,说明平衡正向移动,由于该反应是气体体积减小的反应,所以p1到p2为增大压强的过程,即p1<p2;升高温度,CO的转化率减小,说明平衡逆向移动,该反应正反应为放热反应,即△H<0;
②A.及时分离除CH3OH气体平衡向正反应方向进行,但不能使化学反应速率增大,A不符合题意;
B.适当升高温度反应速率增大,但平衡向逆反应方向进行,B不符合题意;
C.增大H2的浓度能使该反应的反应速率增大,且平衡向正反应方向移动,C符合题意;
D.选择高效催化剂加快反应速率,但平衡不移动,D不符合题意;
答案选C。