题目内容
【题目】某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)![]() C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
【答案】B
【解析】
若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则可以确定![]() ,设B的转化率为x,
,设B的转化率为x,
![]()
![]() ,
,
初始物质的量: 2 3 0 0
变化物质的量: 3x![]()
![]()
![]()
平衡物质的量:![]()
![]() 3x3x
3x3x
 ,计算得出
,计算得出![]() ,即A的转化率是
,即A的转化率是![]() .
.
A、![]() ,故A错误;
,故A错误;
B、达平衡时A的转化率为![]() ,所以B选项是正确的;
,所以B选项是正确的;
C、保持温度不变将容器体积扩大为原来的10倍,速率减小,故C错误;
D、因为反应的热效应不知,所以无法确定,故D错误;
本题答案为B。

【题目】第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:
(1)基态Ga原子价层电子的轨道表达式为_________________________,第一电离能介于N和B之间的第二周期元素有_______种。
(2)HCN分子中σ键与π键的数目之比为_______,其中σ键的对称方式为___________。与CN—互为等电子体的分子为___________。
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为_________。NF3的空间构型为____________。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因_________________________________________________________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如下图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。


① 晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____________;
② GaN的密度为______________________g·cm3(用a、NA表示)。
【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
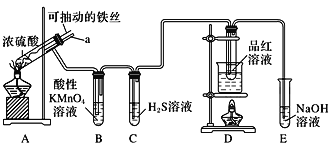
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |


