题目内容
水的电离平衡曲线如图所示:
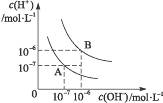
(1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从____________________增加到_____________________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100 ℃的恒温,致使混合液的pH=7,则Ba(OH)2与盐酸的体积之比为________________________________。
(3)已知AnBm的离子积=[C(Am+)]n·[C(Bn-)]m,式中的C(Am+)、C(Bn-)表示离子的物质的量浓度。若某温度下CA(OH)2溶解度为0.74 g,其饱和溶液密度设为1 g·mL-1,其离子积约为_____________________________________________。

(1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从____________________增加到_____________________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100 ℃的恒温,致使混合液的pH=7,则Ba(OH)2与盐酸的体积之比为________________________________。
(3)已知AnBm的离子积=[C(Am+)]n·[C(Bn-)]m,式中的C(Am+)、C(Bn-)表示离子的物质的量浓度。若某温度下CA(OH)2溶解度为0.74 g,其饱和溶液密度设为1 g·mL-1,其离子积约为_____________________________________________。
(1)1×10-14 1×10-12 (2)2∶9 (3)0.004
100 ℃时,pH=6是中性溶液,(2)中的混合溶液pH=7呈碱性,则c(OH-)=10-7 mol·L-1
=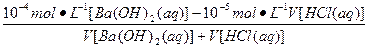 ,
,
整理即可得出二者体积比。(3)中Ca(OH)2的离子积=c(Ca2+)·〔c(OH-)〕2,c〔Ca(OH)2〕=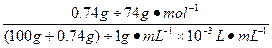 ≈0.1 mol·L-1,故c(Ca2+)="0.1" mol·L-1,c(OH-)="0.2" mol·L-1,代入上式即可解出Ca(OH)2的离子积。
≈0.1 mol·L-1,故c(Ca2+)="0.1" mol·L-1,c(OH-)="0.2" mol·L-1,代入上式即可解出Ca(OH)2的离子积。
=
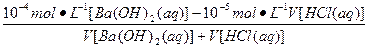 ,
,整理即可得出二者体积比。(3)中Ca(OH)2的离子积=c(Ca2+)·〔c(OH-)〕2,c〔Ca(OH)2〕=
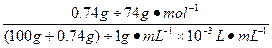 ≈0.1 mol·L-1,故c(Ca2+)="0.1" mol·L-1,c(OH-)="0.2" mol·L-1,代入上式即可解出Ca(OH)2的离子积。
≈0.1 mol·L-1,故c(Ca2+)="0.1" mol·L-1,c(OH-)="0.2" mol·L-1,代入上式即可解出Ca(OH)2的离子积。
练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
 H2S+2OH-
H2S+2OH-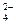 ====BaSO4↓
====BaSO4↓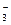 ====CaCO3↓+H2O
====CaCO3↓+H2O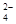 、HCO
、HCO ?
?