题目内容
能正确表示下列反应的离子方程式的是( )
| A.甲酸钠溶液和盐酸反应 HCOO-+H+====HCOOH |
B.硫化钠第一步水解S2-+2H2O H2S+2OH- H2S+2OH- |
C.醋酸钡溶液和硫酸反应Ba2++SO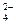 ====BaSO4↓ ====BaSO4↓ |
D.氢氧化钙溶液和碳酸氢镁反应Ca2++OH-+HCO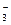 ====CaCO3↓+H2O ====CaCO3↓+H2O |
A
A选项正确;B选项,S2-分步水解,第一步水解的方程式为S2-+H2O HS-+OH-;C选项,除了Ba2+和SO
HS-+OH-;C选项,除了Ba2+和SO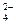 反应外,CH3COO-和H+也能反应,正确离子方程式为:Ba2++2CH3COO-+2H++SO
反应外,CH3COO-和H+也能反应,正确离子方程式为:Ba2++2CH3COO-+2H++SO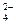 ====BaSO4↓+2CH3COOH;D选项正确,离子方程式为:2Ca2++4OH-+Mg2++2HCO
====BaSO4↓+2CH3COOH;D选项正确,离子方程式为:2Ca2++4OH-+Mg2++2HCO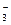 ====2CaCO3↓+Mg(OH)2↓+2H2O。
====2CaCO3↓+Mg(OH)2↓+2H2O。
 HS-+OH-;C选项,除了Ba2+和SO
HS-+OH-;C选项,除了Ba2+和SO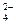 反应外,CH3COO-和H+也能反应,正确离子方程式为:Ba2++2CH3COO-+2H++SO
反应外,CH3COO-和H+也能反应,正确离子方程式为:Ba2++2CH3COO-+2H++SO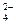 ====BaSO4↓+2CH3COOH;D选项正确,离子方程式为:2Ca2++4OH-+Mg2++2HCO
====BaSO4↓+2CH3COOH;D选项正确,离子方程式为:2Ca2++4OH-+Mg2++2HCO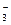 ====2CaCO3↓+Mg(OH)2↓+2H2O。
====2CaCO3↓+Mg(OH)2↓+2H2O。
练习册系列答案
相关题目


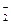 、NO
、NO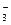
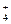 、K+、Cl-、NO
、K+、Cl-、NO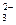
 、SO
、SO 、SO
、SO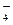 、K+、Cl-、H+、SO
、K+、Cl-、H+、SO