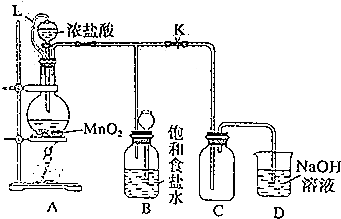
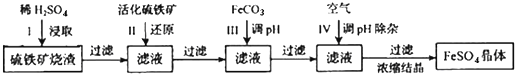
题目内容
3.下列溶液一定显中性的是( )| A. | 25℃时,等体积的0.1mol•L-1 NaOH溶液与0.1mol•L-1的HX溶液混合 | |
| B. | 25℃时,等体积的pH=2盐酸与pH=12的MOH溶液混合 | |
| C. | t℃时,等体积0.2mol•L-1 NaHSO4的溶液与0.2mol•L-1 Ba(OH)2溶液混合 | |
| D. | t℃时,含NaHSO3和Na2SO3的混合溶液中,存在c(HSO3-)+2c(SO32-)=c(Na+) |
分析 A.25℃时,等体积的0.1mol•L-1 NaOH溶液与0.1mol•L-1的HX溶液中n(NaOH)=n(HX),二者恰好反应生成NaX,要根据NaX的类型确定溶液酸碱性;
B.25℃时,等体积的pH=2盐酸与pH=12的MOH溶液混合,如果MOH是强碱,二者恰好反应生成强酸强碱盐,如果MOH是弱碱,则混合溶液中MOH有剩余;
C.t℃时,等体积0.2mol•L-1 NaHSO4的溶液与0.2mol•L-1 Ba(OH)2溶液混合,二者恰好反应生成BaSO4、NaOH、H2O,溶液中溶质为NaOH;
D.t℃时,含NaHSO3和Na2SO3的混合溶液中,存在c(HSO3-)+2c(SO32-)=c(Na+),溶液中还存在电荷守恒c(HSO3-)+2c(SO32-)+c(OH-)=c(Na+)+c(H+),据此判断c(OH-)、c(H+)相对大小.
解答 解:A.25℃时,等体积的0.1mol•L-1 NaOH溶液与0.1mol•L-1的HX溶液中n(NaOH)=n(HX),二者恰好反应生成NaX,如果NaX是强酸强碱盐,其溶液呈中性,如果是强碱弱酸盐,则溶液呈碱性,故A错误;
B.25℃时,等体积的pH=2盐酸与pH=12的MOH溶液混合,如果MOH是强碱,二者恰好反应生成强酸强碱盐,其溶液呈中性,如果MOH是弱碱,则混合溶液中MOH有剩余,混合溶液呈碱性,故B错误;
C.t℃时,等体积0.2mol•L-1 NaHSO4的溶液与0.2mol•L-1 Ba(OH)2溶液混合,二者恰好反应生成BaSO4、NaOH、H2O,溶液中溶质为NaOH,溶液呈碱性,故C错误;
D.t℃时,含NaHSO3和Na2SO3的混合溶液中,存在c(HSO3-)+2c(SO32-)=c(Na+),溶液中还存在电荷守恒c(HSO3-)+2c(SO32-)+c(OH-)=c(Na+)+c(H+),所以得c(OH-)=c(H+),则溶液呈中性,故D正确;
故选D.
点评 本题考查探究溶液酸碱性,为高频考点,明确溶液中溶质及其性质是解本题关键,注意:温度未知时不能根据溶液pH判断溶液酸碱性,要根据溶液中c(OH-)、c(H+)相对大小判断溶液酸碱性,易错选项是D.

 名校课堂系列答案
名校课堂系列答案| A. | 溶液中的Cl-起催化作用 | |
| B. | 溶液中的H+起催化作用 | |
| C. | ClO2逸出,使反应的生成物浓度降低 | |
| D. | 在酸性条件下,亚氯酸钠的氧化性增强 |
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 常温常压下,15gCH3+所含的电子数为9NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 某密闭容器中盛有0.2mol SO2和0.1mol O2,充分反应,生成SO3分子数为0.2NA |
| A. | 维生素一般可分为脂溶性和水溶性 | |
| B. | 维生素容易在内积存,主要积存在肝脏 | |
| C. | 维生素容易被人体吸收,多余的随尿排出体外,不易在体内积存,所以容易缺乏 | |
| D. | 维生素C可以防治夜盲症 |
| A. |  | B. | 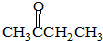 | C. | CH3OCH3 | D. | CH3CH2CH3 |
| A. | 4.6 mol/L | B. | 5.7 mol/L | C. | 3.88 mol/L | D. | 18.4 mol/L |