题目内容
18.某研究性学习小组设计了用氧化浓盐酸的方法制取氯气的实验.其实验装置如图: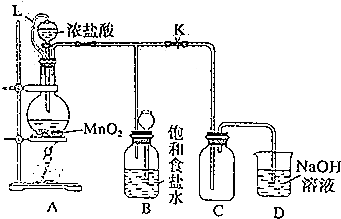
(1)写出圆底烧瓶中发生反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)如果将过量的二氧化锰与20mL 2mol.L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有:①加热使HCl大量挥发②盐酸变稀后不再发生反应
(3)L的作用是平衡压强,便于液体顺利流下,B的作用是吸收氯气中的氯化氢.
(4)为了提高浓盐酸的利用率,你对实验的建议是小火加热.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水;
(4)依据浓盐酸易挥发的性质解答.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;
故答案为:①加热使HCl大量挥发;②盐酸变稀后不再发生反应;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用,便于液体顺利流下;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用饱和食盐水吸收氯气中的氯化氢;
故答案为:平衡压强作用,便于液体顺利流下;吸收氯气中的氯化氢;
(4)因为浓盐酸易挥发,为了提高浓盐酸的利用率,应小火加热,故答案为:小火加热.
点评 本题考查了氯气的制备和性质的检验,明确氯气制备的原理和氯气的性质是解题关键,注意二氧化锰只与浓盐酸反应,题目难度不大.

练习册系列答案
相关题目
8.标准状况下,有1.4g一氧化碳和4.4g二氧化碳组成混合气体,它的密度是( )
| A. | 1.25g/L | B. | 1.73g/L | C. | 1.96g/L | D. | 3.21g/L |
9.6月26日是国际禁毒日,据公安部通报,目前冰毒、摇头丸、氯胺酮等新型毒品在我国有较大传播范围,吸、贩新型毒品问题十分突出,吸毒人数持续增多,滥用种类日趋多样.已知下列四种毒品的结构简式:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 1molK粉最多可以与4molH2发生加成反应 | |
| B. | 摇头丸具有两性 | |
| C. | 冰毒能与盐酸反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
13.我国化学家从白蜡树树皮重提取出白蜡树内酯,队治疗儿童急性菌痢有特效,以白蜡树内酯为原料,在一定条件下可以合成一种抗肿瘤药物-异嗪皮啶,二者结构简式如图所示,下列关于这两种物质说法正确的是( )

| A. | 异嗪皮啶与白蜡树内酯互为同系物 | |
| B. | 白蜡树内酯在一定条件下可以发生水解、加成和取代反应 | |
| C. | 白蜡树内酯的分子式为C10H10O5 | |
| D. | 1mol异嗪皮啶最多可与5mol H2发生加成反应 |
3.下列溶液一定显中性的是( )
| A. | 25℃时,等体积的0.1mol•L-1 NaOH溶液与0.1mol•L-1的HX溶液混合 | |
| B. | 25℃时,等体积的pH=2盐酸与pH=12的MOH溶液混合 | |
| C. | t℃时,等体积0.2mol•L-1 NaHSO4的溶液与0.2mol•L-1 Ba(OH)2溶液混合 | |
| D. | t℃时,含NaHSO3和Na2SO3的混合溶液中,存在c(HSO3-)+2c(SO32-)=c(Na+) |
10.人生病时要合理用药.下列药品与其作用相匹配的是( )
| A. | 氢氧化铝:中和过多胃酸 | B. | 阿司匹林:消炎抗菌 | ||
| C. | 氢氧化钡:胃部透视 | D. | 医用碘酒:人体补碘 |
7.下列事实不能用勒夏特列原理解释的是( )
| A. | 氨水应密闭保存 | |
| B. | 光照新制氯水,溶液中的C(H+)增大 | |
| C. | 工业生产硫酸的过程中使用过量氧气以提高SO2的利用率 | |
| D. | 500℃比室温更有利于氨气的合成 |