题目内容
12.用98%的浓H2SO4(ρ=1.84g/mL)配置1:4的稀硫酸(ρ=1.23gmL),求这种硫酸的物质的量浓度为( )| A. | 4.6 mol/L | B. | 5.7 mol/L | C. | 3.88 mol/L | D. | 18.4 mol/L |
分析 令浓硫酸体积为1000mL,则水的体积为4000mL,则稀硫酸的质量为1000ml×1.84g/cm3+4000ml×1g/ml=(1.84+4)g,根据密度求出硫酸的体积,再根据1000mL浓硫酸中硫酸的质量求出物质的量,然后求出稀硫酸的浓度.
解答 解:令浓硫酸体积为1000mL,则水的体积为4000mL,则稀硫酸的质量为1000ml×1.84g/cm3+4000ml×1g/ml=5840g,
则稀硫酸的体积为V=$\frac{m}{ρ}$=$\frac{5840g}{1.23g/mL}$=4748mL=4.748L,1000mL浓硫酸中硫酸的质量为1000×1.84×98%=1803.2g,则硫酸的物质的量为$\frac{1803.2g}{98g/mol}$=18.4mol,
种硫酸的物质的量浓度为c=$\frac{n}{V}$=$\frac{18.4mol}{4.748L}$=3.88 mol/L;
故选C.
点评 本题考查物质的量浓度的计算及溶液的稀释计算,题目难度不大,并注意利用稀释时溶质的物质的量不变来解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列各组物质中,肯定属于同系物的是( )
| A. | CH4O和C2H6O | B. | C3H6O和C2H4O | C. | 麦芽糖和葡萄糖 | D. | 硬脂酸和软脂酸 |
3.下列溶液一定显中性的是( )
| A. | 25℃时,等体积的0.1mol•L-1 NaOH溶液与0.1mol•L-1的HX溶液混合 | |
| B. | 25℃时,等体积的pH=2盐酸与pH=12的MOH溶液混合 | |
| C. | t℃时,等体积0.2mol•L-1 NaHSO4的溶液与0.2mol•L-1 Ba(OH)2溶液混合 | |
| D. | t℃时,含NaHSO3和Na2SO3的混合溶液中,存在c(HSO3-)+2c(SO32-)=c(Na+) |
20.已知反应: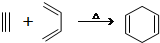 .如果要合成化合物A,其结构为:
.如果要合成化合物A,其结构为: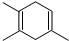 ,下列说法正确的是( )
,下列说法正确的是( )
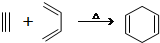 .如果要合成化合物A,其结构为:
.如果要合成化合物A,其结构为: ,下列说法正确的是( )
,下列说法正确的是( )| A. | 合成A的原料可能是:2-丁炔和2-甲基-1,3-丁二烯 | |
| B. | 合成A的原料可能是:丙炔和2,3-二甲基-1,3-丁二烯 | |
| C. | 该反应的原理是取代反应 | |
| D. | 化合物A和HBr 按照物质的量1:1加成时,有三种不同的产物 |
7.下列事实不能用勒夏特列原理解释的是( )
| A. | 氨水应密闭保存 | |
| B. | 光照新制氯水,溶液中的C(H+)增大 | |
| C. | 工业生产硫酸的过程中使用过量氧气以提高SO2的利用率 | |
| D. | 500℃比室温更有利于氨气的合成 |
17.t℃时,某NaCl 溶液中蒸发掉ag水或加入bg NaCl均恰好成为饱和溶液,则t℃时NaCl 的溶解度是( )
| A. | $\frac{b}{a}$g | B. | $\frac{100b}{(a+b)g}$ | C. | $\frac{100b}{a}$g | D. | 无法计算 |
4.下列反应不属于加成反应的是( )
| A. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | B. | 2CH3CH3+5O2$\stackrel{点燃}{→}$2CO2+6H2O | ||
| C. | 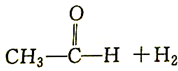 +H2$\stackrel{催化剂}{→}$CH3CH2OH +H2$\stackrel{催化剂}{→}$CH3CH2OH | D. | CH2═CH2+Br2→CH2BrCH2Br |
18.温总理在十届全国人大四次会议上所作的“政府工作报告”中指出:“抓好资源节约,建设环境友好型社会”,这是我国社会及经济长期发展的重要保证.你认为下列行为中有悖于这一保证的是( )
| A. | 开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 | |
| B. | 将煤进行“气化”和“液化”处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |