题目内容
9.为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(含Fe2O3.SiO2.Al2O3等)转变成重要的工业原料FeSO4(反应条件略)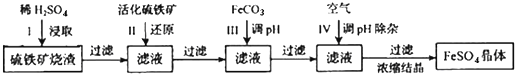
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(2)检验第II步中Fe3+是否完全还原,应选择C(填字母编号).
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第III步加FeCO3调溶液pH=6时,利用相关数据计算,判断Al3+是否沉淀完全?是(填“是”或“否”)(已知Ksp Al(OH)3=1.9×10-33,当离子浓度小于1×10-5mol•L-1时,可认为沉淀完全)
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2═Fe+2Li2S,正极反应式是FeS2+4e-=Fe+2S2-.
分析 硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸铝、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子Al3+,过滤浓缩结晶得到FeSO4晶体,
(1)H2SO4与Fe2O3反应生成硫酸铁与水;
(2)用KSCN 溶液检验第Ⅱ步中Fe3+是否完全还原;
(3)根据KspAl(OH)3计算pH=6时溶液里Al3+的浓度,比较一下就可以判断了;
(4)发生反应:4FeCO3+O2 2Fe2O3+4CO2,根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式;
(5)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-;
解答 解:硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸铝、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子Al3+,过滤浓缩结晶得到FeSO4晶体.
(1)H2SO4与Fe2O3反应生成硫酸铁与水,反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)KMnO4溶液、K3[Fe(CN)6]溶液可以检验有Fe2+生成,取第Ⅱ步反应中溶液少许与试管中,滴加KSCN 溶液,若溶液不变红色,说明Fe3+完全被还原,故答案为:C;
(3)已知KspAl(OH)3=c(Al3+)c3(OH-)=1.9×10-33,当pH=6时c(OH0=1×10-8mol/L,c(Al3+)=$\frac{KspAl(OH)_{3}}{c^3(OH)}=\frac{1.9×1{0}^{-33}}{(1×1{0}^{-8})^3}=1.9×1{0}^{-9}$mol/L<1×10-5mol•L-1,此时Al3+沉淀完全,故答案为:是;
(4)发生反应:4FeCO3+O22Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×4可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
(5)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-,故答案为:FeS2+4e-=Fe+2S2-.
点评 本题为化学工艺流程题,考查离子方程式书写、离子检验、热化学方程式书写、电极反应式、溶度积计算等,需要学生熟练掌握元素化合物知识,对学生的解题能力要求较高,中等难度.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 25℃时,等体积的0.1mol•L-1 NaOH溶液与0.1mol•L-1的HX溶液混合 | |
| B. | 25℃时,等体积的pH=2盐酸与pH=12的MOH溶液混合 | |
| C. | t℃时,等体积0.2mol•L-1 NaHSO4的溶液与0.2mol•L-1 Ba(OH)2溶液混合 | |
| D. | t℃时,含NaHSO3和Na2SO3的混合溶液中,存在c(HSO3-)+2c(SO32-)=c(Na+) |
| A. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | B. | 2CH3CH3+5O2$\stackrel{点燃}{→}$2CO2+6H2O | ||
| C. | 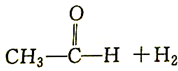 +H2$\stackrel{催化剂}{→}$CH3CH2OH +H2$\stackrel{催化剂}{→}$CH3CH2OH | D. | CH2═CH2+Br2→CH2BrCH2Br |
| A. | 开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 | |
| B. | 将煤进行“气化”和“液化”处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
①稀盐酸 ②氯水 ③亚硫酸 ④氢硫酸.
| A. | 只有①② | B. | 只有②③④ | C. | 只有②④ | D. | ①②③④ |
 ;
;