题目内容
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
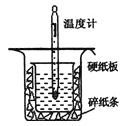
(1)从图中实验装置看,其中尚缺少的一种玻璃用品是___;
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___。
(3)若改用60mL0.25mol·L-1H2SO4和50mL0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量___(填“相等”、“不相等”),若实验操作均正确,则所求中和热___(填“相等”、“不相等”)
(4)50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的实验数据如下表:
请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ①___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=___J/mol(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】环形玻璃搅拌棒 隔热,减少热量的损失 不相等 相等 3.4 -56.8 acd
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是减少热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)①先计算出每次实验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
②先根据Q=mc△t计算反应放出的热量,然后根据△H=-![]() kJ/mol计算出中和热;
kJ/mol计算出中和热;
③根据实验操作分析作答。
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:隔热,减少热量的损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.25mol/LH2SO4和50mL0.55mol/LNaOH溶液进行反应与上述实验相比,生成水的量增多,所放出的热量增多;但是中和热均是强酸和强碱反应生成1mol水时放出的热,中和热相等,故答案为:不相等;相等;
(4)①四次测定温度差分别为3.4℃,5.1℃,3.3℃,3.5℃,其中第2次的温度差误差较大,应该舍弃,其它三次温度差的平均值为t=![]() ℃=3.4℃,故答案为:3.4;
℃=3.4℃,故答案为:3.4;
②50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/cm3=100g,温度变化的值为△t=3.4℃,则生成0.025mol水放出的热量为:Q=mc△t=100g×4.18J/(g℃)×3.4℃=1421.2J=1.4212kJ,所以实验测得的中和热△H=-![]() =-56.8 kJ/mol,故答案为:-56.8;
=-56.8 kJ/mol,故答案为:-56.8;
③计算的数据为-56.8kJ/mol与-57.3kJ/mol有偏差,应为在做实验中有热量损失,
a. 实验装置保温、隔热效果差,有热量损失,a项符合题意;
b.量取NaOH溶液的体积时仰视读数,NaOH溶液体积偏大,放出热量偏大,b项不符合题意;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致较多热量散失,c项符合题意;
d. 温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,由于温度计上会有氢氧化钠,氢氧化钠与硫酸反应放热,导致硫酸的起始温度偏高,温度差偏小,测定结果偏小,d项符合题意;
综上符合题意选项是acd,故答案为:acd。