题目内容
(20分)
(I)多项选择题(6分)
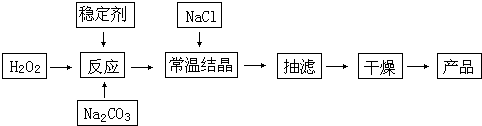
下列关于水处理的说法正确的是 。
A.FeSO4·7H2O是常用的混凝剂,它除去悬浮固体颗粒的过程只是物理过程
B.用纯碱和生石灰处理硬水,既可以除去暂时硬度,也可以除去永久硬度
C.永久硬度的水可以采用离子交换法进行软化,其主要就是利用了离子交换膜技术
D.污水处理中的三级处理是采用化学方法,对污水进行深度处理和净化
E.电渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜
(II)(14分)
下列是工业合成氨的简要流程示意图:
请回答下列问题:
(1)H2通常用碳氢化合物与水反应,写出有关的反应方程式 ,从冷凝器回流到压缩机中的X是 。
(2)比较工业上合成氨和SO2的催化氧化反应,其生产条件有哪些异同,并解释原因
。
(3)将N2、H2按体积比1∶3进入合成塔,从合成塔出来的混合气中,氨的体积分数为15%,则H2的体积分数为______________。
(4)NH3的用途之一是制造化肥,但在化肥的使用过程中要注意铵态氮肥不可以和草木灰混用,解释其原因 。
(5)NH3是一种重要的化工原料,除了制造化肥之外,再列举出两种NH3的用途
。
(20分)
(I)(6分)BD(答对1个得3分,见错得0分。)
(II)(14分)
(1)CH4+H2O3H2+CO(或CH4+2H2O
4H2+CO2),(2分) N2与H2,(1分)
(2)相同点:两个反应均采用了合适的催化剂和较高温度(400℃-500℃),因为催化剂和较高温度均能加快反应速率,提高生产效率。
不同点:①合成氨中采用了较大压强而二氧化硫的催化氧化采用常压。因为前者在常压下原料的转化率很低,后者在常压下原料转化率很高。
②合成氨中氮气与氢气循环利用,提高了原料气的利用率;二氧化硫的催化氧化中使用过量空气,提高了二氧化硫的转化率。(5分,相同点1分,不同点2分,原因2分)
(3)63.75%(2分)
(4)由于NH4+和CO32—在水中分别存在水解平衡,NH4++H2ONH3·H2O+H+,CO32—+H2O
HCO3—+OH—,这两种离子相互促进对方水解程度,使得NH4+变成易分解挥发的NH3·H2O,使肥效降低。(2分)
(5)作制冷剂,制硝酸,制炸药,作燃料电池,用于联合制碱等。(2分,任答两点或其他合理答案均给分。)
解析:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
| A.丙烯分子中有8个σ键,1个π键 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 |
| D.NCl3和BC13分子中,中心原子都采用sp3杂化 |

(II)(14分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,

(3)常温下的TiCl4是有刺激性臭味的无
 色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。

(20分)
(I)多项选择题(6分)
下列关于水处理的说法正确的是 。
| A.FeSO4·7H2O是常用的混凝剂,它除去悬浮固体颗粒的过程只是物理过程 |
| B.用纯碱和生石灰处理硬水,既可以除去暂时硬度,也可以除去永久硬度 |
| C.永久硬度的水可以采用离子交换法进行软化,其主要就是利用了离子交换膜技术 |
| D.污水处理中的三级处理是采用化学方法,对污水进行深度处理和净化 |
 渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜
渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜(II)(14分)
下列是工业合成氨的简要流程示意图:
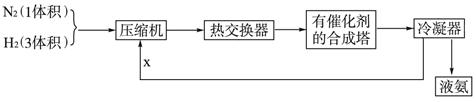
请回答下列问题:
(1)H2通常用碳氢化合物与水反应,写出有关的反应方程式 ,从冷凝器回流到压缩机中的X是 。
(2)比较工业上合成氨和SO2的催化氧化反应,其生产条件有哪些异同,并解释原因
。
(3)将N2、H2按体积比1∶3进入合成塔,从合成塔出来的混合气中,氨的体积分数为15%,则H2的体积分数为______________。
(4)NH3的用途之一是制造化肥,但在化肥的使用过程中要注意铵态氮肥不可以和草木灰混用,解释其原因 。
(5)NH3是一种重要的化工原料,除了制造化肥之外,再列举出两种NH3的用途
。