题目内容
(9分)计算0.01mol/LHCl溶液PH值?在此溶液中由水电离出的c(H+)是多少?若将此酸50ml与50ml 0.012mol/LNaOH混合,溶液中的PH变为多少?(混合后体积的变化忽略不计)
0.001mol/L; 11
考查pH的有关计算。
盐酸是强酸,完全电离,所以溶液中氢离子的浓度是0.01mol/L,因此pH=2。
根据水的离子积常数可知,溶液中OH-的浓度是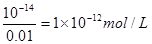
由于溶液中的OH-是水电离出的,而水电离出的氢离子和OH-是相等的
所以此溶液中由水电离出的c(H+)也是1×10-12 mol/L。
由于氢氧化钠的浓度比盐酸的大
所以在体积相同的条件下,氢氧化钠是过量的,即溶液显碱性
C(OH-)=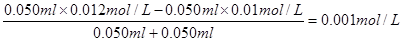
所以氢离子的浓度是1×10-11 mol/L
因此pH=11
盐酸是强酸,完全电离,所以溶液中氢离子的浓度是0.01mol/L,因此pH=2。
根据水的离子积常数可知,溶液中OH-的浓度是
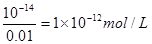
由于溶液中的OH-是水电离出的,而水电离出的氢离子和OH-是相等的
所以此溶液中由水电离出的c(H+)也是1×10-12 mol/L。
由于氢氧化钠的浓度比盐酸的大
所以在体积相同的条件下,氢氧化钠是过量的,即溶液显碱性
C(OH-)=
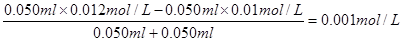
所以氢离子的浓度是1×10-11 mol/L
因此pH=11

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目