题目内容
【题目】2015年10月中国药学家屠呦呦因发现青蒿素(一种用于治疗疟疾的药物)而获得诺贝尔生理医学奖。青蒿素(C15H22O5)的结构如图所示。请回答下列问题:

(1)组成青蒿素的三种元素电负性由大到小排序是 ,在基态O原子中,核外存在 对自旋相反的电子。
(2)下列关于青蒿素的说法正确的是 (填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH + B(OCH3)3 → NaBH4+ 3CH3ONa
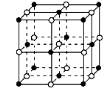
① NaH为 晶体,右图是NaH晶胞结构,则NaH晶体的配位数是 ,若晶胞棱长为a则Na原子间最小核间距为 。
② B(OCH3)3 中B采用的杂化类型是 。写出两个与B(OCH3)3 具有相同空间构型的分子或离子 。
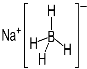
③ NaBH4结构如图所示。结构中存在的作用力有 。
【答案】(1)O>C>H 3 (2)a
(3)① 离子 6 ![]() ②SP2 SO3、CO32-
②SP2 SO3、CO32-
③离子键 配位键 共价键
【解析】
试题分析:(1)组成青蒿素的三种元素为H、C、O,根据元素的非金属性越强,电负性越强知:O>C>H,则H、C、O三种元素的电负性由大到小的顺序是O>C>H;在基态O原子中,核外有8的电子,其中有3个轨道有成对电子,则核外存在3对自旋相反的电子;(2)a.青蒿素中存在O-O键、C-C键,为非极性键,C-O、C-H键为极性键,正确;b.含有饱和碳原子,具有烷烃的结构,则所有碳原子不处于同一平面,错误;c.C=O键含有π键,错误;(3)①NaH为离子晶体,NaH晶体中每个钠离子周围有6个氢负离子,若晶胞棱长为a,则Na原子间最小核间距为![]() ;②B(OCH3)3中B与3个O原子成键,为sp2杂化,B(OCH3)3的相同空间构型平面三角形,与B(OCH3)3具有相同空间构型的分子或离子可为SO3、CO32-;③B原子核最外层有3个电子,NaBH4存在离子键、配位键和共价键。
;②B(OCH3)3中B与3个O原子成键,为sp2杂化,B(OCH3)3的相同空间构型平面三角形,与B(OCH3)3具有相同空间构型的分子或离子可为SO3、CO32-;③B原子核最外层有3个电子,NaBH4存在离子键、配位键和共价键。

 阅读快车系列答案
阅读快车系列答案【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1L密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(l)+H2O(l)△H=+71kJ/mol
CH3OCH3(l)+H2O(l)△H=+71kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H键断裂
(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温 恒容 (T1℃、 2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10min内,用H2O(g)表示的化学反应速率v(H20)=_________mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________。
③在其它条件不变的情况下,若30min时改变温度为T
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________.


