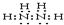题目内容
11.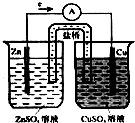 如图是铜锌原电池,又称丹尼尔电池.请回答:
如图是铜锌原电池,又称丹尼尔电池.请回答:(1)电极反应式:正极Cu2++2e-=Cu
(2)电池反应式Zn+Cu2+=Zn2++Cu
(3)盐桥的作用是平衡电荷,构成闭合回路
(4)此电池的优点是极化作用明显减弱,可以较长时间工作.
分析 原电池中负极为较活泼金属,发生氧化反应,在外电路中,电子从负极移向正极,溶液中,阳离子向正极移动,反应的总方程式为:Zn+Cu2+=Zn2++Cu,
解答 解:(1)正极铜离子发生还原反应,电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)电池反应式为Zn+Cu2+=Zn2++Cu,故答案为:Zn+Cu2+=Zn2++Cu;
(3)盐桥的作用是平衡电荷,构成闭合回路,故答案为:平衡电荷,构成闭合回路;
(4)使用该电池极化作用明显减弱,可以较长时间工作,故答案为:极化作用明显减弱,可以较长时间工作.
点评 本题考查原电池的工作原理和盐桥的作用,综合性强,但比较容易.

练习册系列答案
相关题目
2.X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是( )
| A. | 只含极性键的共价化合物 | |
| B. | 含非极性键的共价化合物 | |
| C. | 阴阳离子个数之比为1:1的离子化合物 | |
| D. | 可形成双核离子或者四核离子 |
6.某食品包装袋上的说明如下:
以下说法不正确的是( )
| 品名 | 苏打饼干 |
| 配料 | 面料、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、苏打 |
| 保质期 | 12个月 |
| 生产日期 | 2015年5月15日 |
| A. | 精炼食用植物油能使溴水和酸性KMnO4溶液褪色 | |
| B. | 白砂糖属于二糖,在人体内水解而转化为单糖 | |
| C. | 鲜鸡蛋清遇浓硝酸变为黄色 | |
| D. | 奶油与白砂糖都是高分子化合物 |
3.下列有关电化学原理的说法错误的是( )
| A. | 可充电的电池称“二次电池”,在充电时,是将电能装化为化学能,在放电时,又将化学能转化为电能 | |
| B. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| C. | 对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 | |
| D. | 氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 |
20.下列关于食品安全的做法不正确的是( )
| A. | 用聚氯乙烯塑料袋包装食品 | |
| B. | 在食用盐中添加适量的碘酸钾 | |
| C. | 在食品加工中科学使用食品添加剂 | |
| D. | 研发高效低毒的农药,降低蔬菜的农药残留量 |
1.下列金属防腐蚀的方法中,使用外加电流的阴极保护法的是( )
| A. | 水中的钢闸门连接电源负极 | B. | 在锅炉内壁装上镁合金 | ||
| C. | 汽车底盘喷涂高分子膜 | D. | 在铁板表面镀锌 |
 ;
; .
.