题目内容
【题目】二氧化碳的捕集和转化是科学研究中的热点问题。我国科研人员提出了以Ni/Al2O3为催化剂,由 CO2(g)和H2(g)转化为CH4(g)和H2O(g)的反应历程,其示意图如下:

(1)该可逆反应的化学方程式为_________。使用催化剂Ni/Al2O3_________ (填“能”或“不能”)提髙CO2的平衡转化率。
(2)300℃下,在一恒容密闭容器中充入一定量的CO2与H2,发生上述反应,一段时间后反应达平衡,若其他条件不变,温度从300℃升至500℃,反应重新达到平衡时,H2的体积分数增加。下列说法错误的是_________(填标号)。
A.该反应的![]()
B.平衡常数大小:![]()
C.300℃下,减小![]() 的值,
的值,![]() 的平衡转化率升高
的平衡转化率升高
D.反应达到平衡时化![]()
(3)在一定条件下,反应体系中CO2的平衡转化率a( CO2)与L和X的关系如图所示,L和X表示温度或压强。

①X表示的物理量是___________。
②L1_____________L2(填“<”“>”),判断理由是______________________________________。
(4)向1 L恒容密闭容器中加入4.0 mol H2(g),1.0 mol CO2,控制条件(催化剂为 Ni/AI2O3、温度为T1)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示。

①4 min时CO2的转化率为___________。
②T1温度下该反应的化学平衡常数为___________。
【答案】CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) 不能 BC 温度 > 该反应为气体分子数减小的反应,其他条件一定时,增大压强,平衡右移,CO2的平衡转化率升髙 75% 6.75
CH4(g)+2H2O(g) 不能 BC 温度 > 该反应为气体分子数减小的反应,其他条件一定时,增大压强,平衡右移,CO2的平衡转化率升髙 75% 6.75
【解析】
(1)根据图示书写该可逆反应的化学方程式;催化剂只能加快反应的速率,不能提高CO2的平衡转化率;
(2)A.温度从300℃升至500℃反应重新达到平衡时,H2的体积分数增加,根据温度对平衡移动的影响分析;
B.正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
C.减小![]() 的值,CO2的含量增大,据此分析;
的值,CO2的含量增大,据此分析;
D.反应达到平衡时,反应速率之比等于化学计量数之比;
(3)①根据方程式 CO2(g) +4H2(g)![]() CH4(g) +2H2O(g)及反应的
CH4(g) +2H2O(g)及反应的![]() H<0 可知结合图像转化率的变化分析判断影响因素;
H<0 可知结合图像转化率的变化分析判断影响因素;
②结合题图及①中的分析判断;
(4)由题图可知,4 min时反应体系处于平衡状态,此时压强为0. 7p0,结合气体压强之比等于物质的量之比,列出三段式计算CO2的转化率及反应平衡常数。
(1)由题意可知该可逆反应的化学方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) +2H2O(g),催化剂只能加快反应的速率,不能提高CO2的平衡转化率;
CH4(g)+2H2O(g) +2H2O(g),催化剂只能加快反应的速率,不能提高CO2的平衡转化率;
(2)A.对于该可逆反应,若其他条件不变, 温度从300℃升至500℃反应重新达到平衡时,H2的体积分数增加,说明正反应为放热反应,故A正确;
B.正反应为放热反应,因此![]() ,故B错误;
,故B错误;
C.减小![]() 的值,CO2的平衡转化率降低,故C错误;
的值,CO2的平衡转化率降低,故C错误;
D.反应达到平衡时,![]() ,故D正确;
,故D正确;
答案选BC;
(3)①根据方程式 CO2(g) +4H2(g)![]() CH4(g) +2H2O(g)及反应的
CH4(g) +2H2O(g)及反应的![]() H<0 可知,其他条件一定时,升温,CO2的平衡转化率降低,其他条件一定时,加压,CO2的平衡转化率升高,则X表示的物理量是温度;
H<0 可知,其他条件一定时,升温,CO2的平衡转化率降低,其他条件一定时,加压,CO2的平衡转化率升高,则X表示的物理量是温度;
②L表示压强,结合题图及上述分析,可知L1>L2;
(4)①由题图可知,4 min时反 应体系处于平衡状态,此时压强为0. 7p0,设发生反应的CO2为x mol,列出三段式:
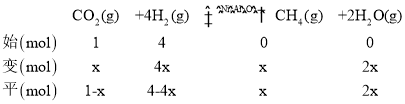
根据恒温恒容条件下,气体压强之比等于物质的量之比得出![]() ,解得 x=0.75,则CO2的转化率为
,解得 x=0.75,则CO2的转化率为![]() ;
;
②平衡常数![]() 。
。

 阅读快车系列答案
阅读快车系列答案