题目内容
【题目】研究CO2与CH4反应转化为CO和H2,对减缓燃料危机、减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=___kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。

①下列事实能说明该反应一定达到平衡的是____。
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位______,理由是____。
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压*物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式____________。
【答案】(1)+160kJ·mol-1 (2)①ac②p4>p1>p2>p3反应前后气体分子数增大,相同温度下,压强升高,甲烷的平衡转化率降低③12.6p42
(3)0.1mol·L-14×10-9 (4)2CN-+5CIO-+H2O=2CO2↑+N2↑+5CI-+2OH-
【解析】
试题分析:(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1
则根据盖斯定律可知③-②-①即得到CH4(g)+CO2(g)= 2CO(g)+2H2(g)的△H=+160kJ·mol-1。
(2)①a.CO2的浓度不在发生变化说明反应达到平衡状态,a正确;b.v(CH4)=2v(CO)没有指明反应的方向,气味不能满足反应速率之比是化学计量数制备,则没有达到平衡状态,b错误;c.气体的质量不变,但物质的量变化,因此混合气体的平均相对分子质量不发生变化说明反应达到平衡状态,c正确;d.CO与H2的物质的量比为1:1不能说明反应达到平衡状态,d错误,答案选ac。
②反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)为气体分子数增加的反应,当温度一定时,减小压强,可增大CH4的转化率,从图像可知,相同温度下,按p4、p1、p2、p3的顺序CH4的转化率增大,所以p4>p1>p2>p3。③在恒容密闭容器中通入n mol CH4与,n mol CO2,反应在图象中X点的甲烷转化率为50%,
2CO(g)+2H2(g)为气体分子数增加的反应,当温度一定时,减小压强,可增大CH4的转化率,从图像可知,相同温度下,按p4、p1、p2、p3的顺序CH4的转化率增大,所以p4>p1>p2>p3。③在恒容密闭容器中通入n mol CH4与,n mol CO2,反应在图象中X点的甲烷转化率为50%,
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始量(mol) n n 0 0
变化量(mol) 0.8n 0.8n 1.6n 1.6n
平衡量(mol) 0.2n 0.2n 1.6n 1.6n
则P(CH4)=P(CO2)=![]()
P(CO)=P(H2)=![]()
Kp=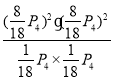 =12.6p42
=12.6p42
(3)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O![]() (NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,则
(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,则
NH4++H2O![]() H++NH3H2O
H++NH3H2O
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数K=![]() =4×10-9。
=4×10-9。
(4)用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,气体是氮气和CO2,所以该反应的离子方程式2CN-