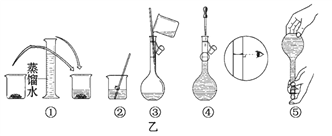
题目内容
【题目】某工厂生产废液中含有大量的Cu2+ 、Fe3+、Fe2+ 、![]() 。某兴趣小组设计了以下方案,对废液加以综合利用获得了Cu和绿矾(FeSO4·7H2O):
。某兴趣小组设计了以下方案,对废液加以综合利用获得了Cu和绿矾(FeSO4·7H2O):

请回答以下问题:
(1)操作1和操作2的名称是________。
(2)废液中加过量铁时发生反应的离子方程式为_______________、________________。
(3)合并溶液1和溶液2后,系列操作3包含__________、____________、过滤等操作。
(4)若使用得到的绿矾晶体制备净水剂Fe2(SO4)3溶液,除在绿矾中加入适量稀硫酸外,还需要加入____(填标号)。
①稀H2SO4 ②Cl2 ③H2O2 ④Fe粉
【答案】过滤 Fe + Cu2+ = Fe2+ +Cu Fe +2Fe3+ = 3Fe2+ 蒸发浓缩 冷却结晶 ③
【解析】
向含有大量的Cu2+、Fe3+、Fe2+、SO42-的废液中加入过量Fe粉,过滤所得滤渣1为Fe和Cu,滤液1中含有Fe2+和SO42-;用过量稀硫酸再溶解滤渣1,过滤除去Cu,滤液2与滤液1合并后蒸发浓缩、再冷却结晶并过滤得到绿矾晶体。
(1)操作1和操作2的目的是固液分离,则操作名称均为过滤;
(2)废液中加过量铁是为了还原Cu2+和Fe3+,则发生反应的离子方程式为Fe + Cu2+= Fe2+ +Cu、Fe +2Fe3+= 3Fe2+;
(3) 滤液2与滤液1合并后蒸发浓缩、再冷却结晶并过滤得到绿矾晶体;
(4)若使用得到的绿矾晶体制备净水剂Fe2(SO4)3溶液,除在绿矾中加入适量稀硫酸外,还需要加入加入氧化剂,氧化Fe2+生成Fe3+,同时不引入杂质,则:
①稀H2SO4只能起酸化作用,故①错误;
②Cl2能氧化Fe2+,但引入Cl-,故②错误;
③H2O2能氧化Fe2+,且不影响溶液的成分,故③正确;
④Fe粉只有还原性,不能氧化Fe2+,故④错误;
故答案为③。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】昆明得天独厚的气候地理条件,造就了亚洲第一鲜花交易市场。生活中人们为了延长鲜花的寿命,通常会加入鲜花保鲜剂。
下表是0.25 L某种鲜花保鲜剂中含有的成分及含量(部分成分省略)。回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 12.50 | 342 |
硫酸钾(K2SO4) | 0.125 | 174 |
高锰酸钾(KMnO4) | 0.125 | 158 |
硝酸银(AgNO3) | 0.01 | 170 |
…… | …… | …… |
(1)鲜花保鲜剂的下列成分中,不属于电解质的是__________(填标号)。
a.C12H22O11 b.K2SO4 c.KMnO4 d.AgNO3
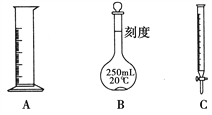
(2)欲配制250 mL该鲜花保鲜剂,现已提供下列仪器:①250mL容量瓶②量筒③烧杯④药匙⑤电子天平,如要完成实验,缺少的玻璃仪器还有_________、_________ (写仪器名称)。
(3)下列操作会使所配鲜花保鲜剂浓度偏低的是__________(填标号)。
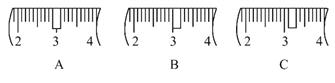
a.容量瓶用蒸馏水洗净后没有烘干 b.用玻璃棒引流,将溶液转移到容量瓶中时有溶液洒到了容量瓶外面 c.定容时俯视刻度线 d.滴加蒸馏水,使溶液凹面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液面比刻度线低,再加水至刻度线
(4)写出该鲜花保鲜剂中K+的物质的量浓度的计算式(省略成分中不含K+)_______(不必化简)。