题目内容
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为__________________;基态钙原子核外电子排布式为_________________;熔点:MgO(2852℃)高于CaO(2614℃),其原因是_____________________________。
(2)![]() 。NH4HF2中所含作用力有____________(填字母)。
。NH4HF2中所含作用力有____________(填字母)。
a. 氢键 b. 配位键 c. 共价键 d. 离子键 e. 金属键
(3)已知: ![]() .
.
①NH4+ 的空间构型为___________,与NH4+ 互为等电子体的分子或离子有_____(写两种)
②CO32- 中碳原子杂化轨道类型为______________________。
③分解产物中属于非极性分子的是_____________________(填字母)。
a. NH3 b. CO2 c. N2 d. H2O
(4)UO2 的晶胞结构及晶胞参数如下图所示:
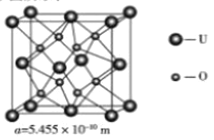
①晶胞中U的配位数为_________________。
②UO2 的密度为__________g·cm-3(列出计算式即可,用NA表示阿伏伽德罗常数的值)。
【答案】 68% ![]() 或[Ar]4s2 CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高 abcd 正四面体 CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等 sp2 bc 8
或[Ar]4s2 CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高 abcd 正四面体 CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等 sp2 bc 8 
【解析】(1)根据不同堆积方式的空间利用率可知,体心立方堆积空间利用率为68%;Ca是20号元素,原子核外电子数为20,基态原子核外电子排布式为:1s22s22p63s23p64s2或[Ar]4s2;CaO和MgO都是离子晶体,且离子的电荷数相等,但镁离子的半径比钙离子的半径小,镁离子对氧离子的作用比钙离子强,因此氧化镁的晶格更加牢固,晶格能更大,故MgO晶体的熔点高于CaO。
(2)NH4HF2中NH4+与HF2-之间为离子键,N-H为(极性)共价键、配位键,HF2-的结构式为[F-HF]-,含有(极性)共价键和氢键;故选abcd。
(3)①NH4+中价层电子对个数是4且不含孤电子对,为sp3 杂化,四个N-H键的键能、键长及键角均相同,空间构型为正四面体;原子总数相同、价电子总数相同的粒子互称为等电子体,NH4+共有5个原子,8个价电子,与其互为等电子体的分子或离子有:CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等。②CO32-中σ键个数=配原子个数=3,,且不含孤电子对,所以C原子采用sp2杂化。③NH3为极性键构成的三角锥型分子,结构不对称,是极性分子;CO2呈直线型,结构对称,是非极性分子;N2为非极性键组成的双原子分子,结构对称,是非极性分子;H2O为极性键构成的V型分子,是极性分子;故选bc。
(1)①晶胞不是孤立的,在UO2晶胞中每个U4+连接4个氧离子,但在下面一个晶胞中又连接4个氧离子,所以其配位数为8。②用均摊法可求得平均每个晶胞中U4+个数为:8×![]() +6×
+6×![]() =4,O2-个数为8,晶胞质量为:m=
=4,O2-个数为8,晶胞质量为:m=![]() g=
g=![]() g,晶胞体积为:V=a3=(5.455×10-10m)3=(5.455×10-8cm)3,则UO2的密度为:ρ=m/V=
g,晶胞体积为:V=a3=(5.455×10-10m)3=(5.455×10-8cm)3,则UO2的密度为:ρ=m/V= g·cm-3。
g·cm-3。
